Co je platina a bílé zlato? Aplikace platiny. Kde a jak se používá platina Atomová hmotnost platiny
Platina- minerál, přírodní Pt ze skupiny platiny třídy nativních prvků, obvykle obsahuje Pd, Ir, Fe, Ni. Čistá platina je velmi vzácná, většina vzorků je zastoupena železitou odrůdou (polyxen) a často intermetalickými sloučeninami: isoferoplatina (Pt,Fe) 3 Fe a tetraferoplatina (Pt,Fe)Fe. Platina, reprezentovaná polyxenem, je nejběžnějším minerálem podskupiny platiny v zemské kůře.
Viz také:
STRUKTURA
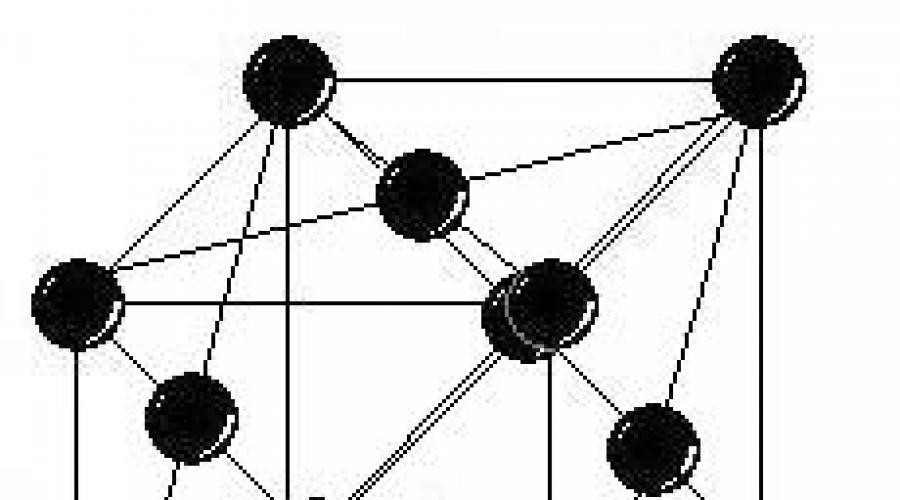
 Krystalová mřížka platiny patří do kubické soustavy. Molekula cyklohexenu má tvar pravidelného šestiúhelníku. V uvažovaném reakčním systému mají atomová struktura katalyzátoru a reagující molekuly jednu společnou vlastnost – prvky symetrie třetího řádu. V krystalu platiny je toto uspořádání atomů vlastní pouze oktaedrické ploše. Uzly obsahují atomy platiny. a = 0,392 nm, Z = 4, prostorová grupa Fm3m
Krystalová mřížka platiny patří do kubické soustavy. Molekula cyklohexenu má tvar pravidelného šestiúhelníku. V uvažovaném reakčním systému mají atomová struktura katalyzátoru a reagující molekuly jednu společnou vlastnost – prvky symetrie třetího řádu. V krystalu platiny je toto uspořádání atomů vlastní pouze oktaedrické ploše. Uzly obsahují atomy platiny. a = 0,392 nm, Z = 4, prostorová grupa Fm3m VLASTNOSTI
 Barva polyxenu je stříbrnobílá až ocelově černá. Palubní deska je ocelově šedá. Lesk je typický kovový. Odrazivost v leštěných částech je vysoká - 65-70.
Barva polyxenu je stříbrnobílá až ocelově černá. Palubní deska je ocelově šedá. Lesk je typický kovový. Odrazivost v leštěných částech je vysoká - 65-70.
Tvrdost 4-4,5, pro odrůdy bohaté na iridium - až 6-7. Má tvárnost. Zlomenina je zaháknutá. Štěpení obvykle chybí. Oud. váha-15-19. Byla zaznamenána souvislost mezi sníženou měrnou hmotností a přítomností dutin obsazených zemními plyny, jakož i inkluzí cizích minerálů. Je to magnetické, paramagnetické. Dobře vede elektřinu. Platina je jedním z nejvíce inertních kovů. Je nerozpustný v kyselinách a zásadách, s výjimkou aqua regia. Platina také přímo reaguje s bromem a rozpouští se v něm.
Při zahřátí se platina stává reaktivnější. Reaguje s peroxidy a při kontaktu se vzdušným kyslíkem s alkáliemi. Tenký platinový drát hoří ve fluoru za uvolnění velkého množství tepla. Reakce s jinými nekovy (chlór, síra, fosfor) jsou méně aktivní. Při silnějším zahřívání reaguje platina s uhlíkem a křemíkem za vzniku pevných roztoků, podobně jako u kovů skupiny železa.
REZERVY A VÝROBA
 Platina je jedním z nejvzácnějších kovů: její průměrný obsah v zemské kůře (clarke) je 5 10 -7 % hmotnosti. I tzv. nativní platina je slitina obsahující od 75 do 92 procent platiny, do 20 procent železa, dále iridium, palladium, rhodium, osmium, méně často měď a nikl.
Platina je jedním z nejvzácnějších kovů: její průměrný obsah v zemské kůře (clarke) je 5 10 -7 % hmotnosti. I tzv. nativní platina je slitina obsahující od 75 do 92 procent platiny, do 20 procent železa, dále iridium, palladium, rhodium, osmium, méně často měď a nikl.
Prozkoumané světové zásoby kovů platinové skupiny jsou asi 80 000 tun a jsou distribuovány zejména mezi Jižní Afrikou (87,5 %), Ruskem (8,3 %) a USA (2,5 %).
V Rusku jsou hlavními ložisky kovů platinové skupiny: ložiska Okťabrskoje, Talnachskoje a Norilsk-1 sulfid-měď-niklová ložiska na Krasnojarském území v Norilské oblasti (více než 99 % prozkoumaných a více než 94 % odhadovaných ruských rezervy), Fedorova Tundra (oblast Bolshoy Ikhtegipakhk) sulfid-měď-nikl v oblasti Murmansk, stejně jako rýžoviště Kondyor na území Chabarovsk, Levtyrinyvayam na území Kamčatky, řeky Lobva a Vyysko-Isovskoe v oblasti Sverdlovsk. Největší platinový nuget nalezený v Rusku je „Uralský obr“ o hmotnosti 7860,5 g, objevený v roce 1904. na dole Isovský.
Na dolech se těží nativní platina, méně bohatá jsou sypká ložiska platiny, která jsou zkoumána především metodou schlichových vzorkování.
Výrobu platiny v práškové formě zahájil v roce 1805 anglický vědec W. H. Wollaston z jihoamerické rudy.
Dnes se platina získává z koncentrátu platinových kovů. Koncentrát se rozpustí v aqua regia, poté se přidá ethanol a cukerný sirup, aby se odstranil přebytek HNO3. V tomto případě se iridium a palladium redukují na Ir3+ a Pd2+. Hexachloroplatičitan amonný (IV) (NH 4) 2PtCl6 se izoluje následným přidáním chloridu amonného. Vysušená sraženina se kalcinuje při 800-1000 °C
Takto získaná houbová platina se podrobí dalšímu čištění opětovným rozpuštěním v aqua regia, vysrážením (NH4)2PtCl6 a kalcinací zbytku. Vyčištěná houbovitá platina se pak roztaví do ingotů. Při regeneraci roztoků platinových solí chemickou nebo elektrochemickou metodou se získá jemně dispergovaná platina - platinová čerň.
PŮVOD
 Minerály skupiny platiny se většinou nacházejí v typických vyvřelých ložiskách geneticky příbuzných ultramafickým vyvřelým horninám. Tyto minerály v rudních tělesech vynikají mezi křemičitany a oxidy v okamžicích odpovídajících hydrotermálnímu stádiu magmatického procesu. Minerály platiny chudé na palladium (polyxen, iridiscentní platina atd.) se nacházejí v ložiskách mezi dunity, horninami bez olivínů, bohatými na hořčík a chudými na oxid křemičitý. Parageneticky jsou přitom úzce spřízněni s chromovými spinely. Palladium až nikl-palladium platina je distribuována převážně v hlavních vyvřelinách skály(nority, gabronority) a obvykle se pojí se sulfidy: pyrhotit, chalkopyrit a pentlandit.
Minerály skupiny platiny se většinou nacházejí v typických vyvřelých ložiskách geneticky příbuzných ultramafickým vyvřelým horninám. Tyto minerály v rudních tělesech vynikají mezi křemičitany a oxidy v okamžicích odpovídajících hydrotermálnímu stádiu magmatického procesu. Minerály platiny chudé na palladium (polyxen, iridiscentní platina atd.) se nacházejí v ložiskách mezi dunity, horninami bez olivínů, bohatými na hořčík a chudými na oxid křemičitý. Parageneticky jsou přitom úzce spřízněni s chromovými spinely. Palladium až nikl-palladium platina je distribuována převážně v hlavních vyvřelinách skály(nority, gabronority) a obvykle se pojí se sulfidy: pyrhotit, chalkopyrit a pentlandit.
V exogenních podmínkách se v procesu destrukce primárních ložisek a hornin tvoří sypače obsahující platinu. Většina minerálů podskupiny platiny je za těchto podmínek chemicky stabilní. Platina se v sypačích vyskytuje ve formě nugetů, vloček, destiček, koláčů, konkrementů, stejně jako kosterních forem a houbovitých sekretů o velikosti od 0,05 do 5 mm, někdy až 12 mm. Zploštělá a lamelární zrna platiny naznačují značnou vzdálenost od primárních zdrojů a redepozice. Dosah přenosu platiny v rýžovištích obvykle nepřesahuje 8 km, v šikmých rýžovištích je delší. Palladiové a měďnaté odrůdy platiny v zóně hypergeneze mohou být "zušlechtěny", přičemž ztratí Pd, Cu, Ni. Obsah Cu a Ni podle A.G. Betekhtin v platině z placerů může být snížen více než 2krát ve srovnání s platinou z primárního zdroje. V rýžovištích mnoha oblastí světa jsou popsány nově vzniklé chemicky čisté platiny a palladium platiny ve formě slinutých forem radiálně sálavé struktury.
APLIKACE
 Sloučeniny platiny (především aminoplatinaty) se používají jako cytostatika v terapii různé formy rakovina. První v klinická praxe byla zavedena cisplatina (cis-dichlordiaminplatina(II)), ale v současnosti se používají účinnější komplexy karboxylátu diaminplatiny, karboplatina a oxaliplatina.
Sloučeniny platiny (především aminoplatinaty) se používají jako cytostatika v terapii různé formy rakovina. První v klinická praxe byla zavedena cisplatina (cis-dichlordiaminplatina(II)), ale v současnosti se používají účinnější komplexy karboxylátu diaminplatiny, karboplatina a oxaliplatina.
K výrobě se široce používá platina a její slitiny šperky.
První platinové mince na světě byly vydány a byly v oběhu v Ruské říši od roku 1828 do roku 1845. Ražba začala s třírublovými mincemi. V roce 1829 byly založeny „platinové duplons“ (šestirublové bankovky) a v roce 1830 „čtyřnásobky“ (dvanáctirublové bankovky). Razily se tyto nominální hodnoty mincí: nominální hodnoty 3, 6 a 12 rublů. Třírublových mincí bylo vyraženo 1 371 691 kusů, šestirublových bankovek - 14 847 kusů. a dvanáct rublů - 3474 ks.
Platina byla použita při výrobě insignií za vynikající služby: obraz V. I. Lenina byl vyroben z platiny na sovětský Leninův řád; z toho vznikl sovětský řád „Vítězství“, řád Suvorova 1. stupně a řád Ušakova 1. stupně.
- Od první čtvrtiny 19. století se v Rusku používá jako legovací přísada pro výrobu vysokopevnostních ocelí.
- Jako katalyzátor se používá platina (nejčastěji ve slitině s rhodiem a také ve formě platinové černi - jemného prášku platiny získaného redukcí jejích sloučenin).
- Platina se používá k výrobě nádob a míchadel používaných při tavení optických skel.
- Pro výrobu chemicky a pevného tepelně odolného laboratorního skla (kelímky, lžíce atd.).
- Pro výrobu permanentních magnetů s vysokou koercitivní silou a zbytkovou magnetizací (slitina tří dílů platiny a jednoho dílu kobaltu PlK-78).
- Speciální zrcadla pro laserovou technologii.
- Pro výrobu odolných a stabilních elektrických kontaktů ve formě slitin s iridiem, například kontakty elektromagnetických relé (slitiny PLI-10, PLI-20, PLI-30).
- Galvanické povlaky.
- Destilační retorty na výrobu kyseliny fluorovodíkové, získávání kyseliny chloristé.
- Elektrody pro výrobu chloristanů, perboritanů, perkarbonátů, kyseliny peroxysírové (ve skutečnosti použití platiny určuje celou světovou produkci peroxidu vodíku: elektrolýza kyseliny sírové - kyselina peroxysírová - hydrolýza - destilace peroxidu vodíku).
- Nerozpustné anody při galvanickém pokovování.
- Topná tělesa odporových pecí.
- Výroba odporových teploměrů.
- Povlaky pro prvky mikrovlnné techniky (vlnovody, atenuátory, rezonátorové prvky).
Platina - Pt
KLASIFIKACE
| Strunz (8. vydání) | 1/A.14-70 |
| Nickel-Strunz (10. vydání) | 1.AF.10 |
| Dana (7. vydání) | 1.2.1.1 |
| Dana (8. vydání) | 1.2.1.1 | Ahoj, CIM Ref | 1.82 |
FYZIKÁLNÍ VLASTNOSTI
OPTICKÉ VLASTNOSTI
KRYSTALOGRAFICKÉ VLASTNOSTI
| skupina teček | m3m (4/m 3 2/m) - izometrický hexaoktaedr |
| vesmírná skupina | Fm3m |
| Syngonie | krychlový |
| Možnosti buňky | a = 3,9231 Á |
| Twinning | celkem podle (111) |
Rychlé textové vyhledávání
Nejcennější z kovů
Historie objevu kovu nás vrací o několik tisíc let zpět. Názory na to, kdy byla objevena platina, se různí. Někteří učenci tvrdí, že tento kov byl znám a aktivně používán takovými starověkými civilizacemi, jako jsou kmeny Inků, Aztéků a Mayů. Tyto civilizace však existovaly tak dávno, že o tom neexistují žádné spolehlivé údaje.
Verze jiných výzkumníků zní pravděpodobněji. Platinu objevil člověk v 18. století v Jižní Americe. Lidé tehdy neznali její obrovskou hodnotu a k platině se chovali pohrdavě. Kvůli jeho podobnosti se stříbrem a kvůli neschopnosti jej roztavit.
Dnes je hodnota platiny člověku dobře známá. Podle Centrální banky Ruské federace je cena platiny 1 743,75 rublů za gram.
Chemické složení platiny
V čistá forma Stejně jako jiné drahé kovy je platina vzácná. Nejběžnější jsou nugety, ve kterých většinu (80 % -88 %) tvoří platina a zbytek tvoří železo. Tato odrůda se nazývá polyxen. Existují také odrůdy obsahující nikl (asi 3 % niklu), palladium (od 7 % do 40 % palladia), iridium, rhodium (až 5 % rhodia).

V periodické tabulce se nazývá Platina, má označení Pt. Skupina - 10, perioda - 6, atomové číslo - 78, atomová hmotnost - 195,084 g / mol. Platina neinteraguje s většinou prvků. Nicméně pod vlivem vysoké teploty může dojít k reakci.
Platina reaguje s:
- "královská vodka" - rozpouští se v ní při obvyklé teplotě;
- kyselina sírová - rozpouští se v koncentrátu, při zvýšené teplotě;
- kapalný brom - rozpouští se v koncentrátu, při zvýšených teplotách;

Při vystavení vysokým teplotám:
- alkálie;
- peroxid sodný;
- halogeny;
- síra;
- uhlík (tvoří pevný roztok);
- selen;
- křemík (vytváří pevný roztok);
- kyslík (tvoří těkavé oxidy).
Kov je dobrý katalyzátor. Jako katalyzátor je v průmyslu nepostradatelný.
Má kubickou plošně centrovanou krystalovou mřížku
Ve volném stavu je kov monatomickou molekulou

Fyzikální vlastnosti
V přírodě se nejčastěji vyskytuje ve formě šedobílých nugetů velikosti od malých zrnek až po kamínky o hmotnosti 8 kg.
Hlavní fyzikální vlastnosti:
- p = 21,09-21,45 g/cm3;
- Teplota tání - 1768,3 ᵒС;
- Bod varu - 3825 ᵒС;
- Tepelná vodivost - 71,6 W / m × K;
- Tvrdost na Mohsově stupnici - 3,5.
Platina bez nečistot je diamagnet. Častěji se však v přírodě vyskytuje ve formě polyxenu, který je magnetizován. Má vysokou elektrickou vodivost a tažnost (duktilitu a tažnost).
Kov se nejaktivněji používá v chemickém průmyslu. Pro svou tažnost a elektrickou vodivost je vhodný pro výrobu kyseliny sírové, ale i laboratorního chemického skla, které je vystaveno vysokým teplotám.
Kov je široce používán v elektrotechnickém průmyslu, v případě potřeby pokovování, jako povlak různých prvků elektrických zařízení.
Platina jako katalyzátor je nepostradatelná v průmyslu rafinace ropy.
Kromě toho je hodnota kovu velká v automobilovém, sklářském, peněžním průmyslu, ve šperkařství, medicíně (zejména ve stomatologii).
Těžba platiny
Prvenství v těžbě cenného kovu patří Rusku, Jižní Africe, Kanadě, USA, Kolumbii. Roční produkce je 36 tun kovu.
Američané byli první, kdo těžil platinu. Rusko objevilo platinu mnohem později, v roce 1819 na Uralu. Následně bylo objeveno několik dalších nalezišť cenného kovu. Již v roce 1828 byla produkce v Rusku 1,5 tuny. To výrazně překonalo výsledky Jižní Ameriky. Na konci 19. století se Rusko stalo nesporným vůdcem a získalo 40krát cennější kov než všechny ostatní země.

Současným lídrem je Jižní Afrika. Rusko je na druhém místě a vyrábí asi 25 tun ročně. Světové zásoby platiny dnes dosahují přibližně 80 tisíc tun a jsou rozděleny mezi Jižní Afriku, Rusko a Ameriku.
umělá platina
Platina je považována za vzácný, drahý kov. Jeho extrakce a následný poměrně komplikovaný a časově náročný proces. Přesto je široce používán téměř ve všech oblastech průmyslu a lidského života. Jeho cena je poměrně vysoká a pokles se neočekává. Poptávka po kovu roste a jeho množství v přírodě pouze klesá. Aby byl kov dostupnější a poněkud snížila jeho cena, rozhodla se Světová investiční rada tento kov uměle syntetizovat. Na této problematice se aktivně podílí i ruské vědecké centrum „Synthestech“. Pro výrobu umělé platiny se používá metoda studené transmutace.
Světle stříbřitý odstín, lesklý a na vzduchu nebledne. Kromě toho je platina velmi žáruvzdorný, odolný a zároveň kujný kov, což je však pro mnohé společné platinoidy. Platina je poměrně vzácný a cenný kov, který se v zemské kůře vyskytuje mnohem méně často než například zlato nebo stříbro. Mimochodem, svůj název získal právě díky tomu druhému. Ve španělštině je „plata“ stříbro a „platina“ je podobné stříbru.
Datum objevení platiny není přesně známo, protože ji objevili Inkové v Jižní Americe. V Evropě se první zmínka o platině (jako neznámém kovu, který nelze roztavit – protože její teplota tání je téměř 1770 stupňů Celsia) objevuje v 16. století díky výbojům španělských conquistadorů. Pravidelné dodávky platiny do západní Evropy z Jižní Ameriky se však zlepšily až v 17.–18. Oficiálně se mezi evropskými vědci začal považovat za nový kov až v roce 1789, poté, co francouzský chemik Lavoisier publikoval svůj Seznam jednoduchých látek.
Čistá, bez cizích příměsí, platina byla extrahována z platinové rudy již v roce 1803 britským vědcem Williamem Wollastonem. Současně objevil další dva platinoidy (kovy skupiny platiny) ze stejné rudy – palladium a rhodium. Zajímavé je, že ve stejné době byl Wollaston původně lékařem, který se začal zajímat o výrobu lékařského náčiní a nástrojů z platiny – pro její baktericidní vlastnosti a neuvěřitelnou odolnost vůči oxidačním činidlům. Byl to on, kdo jako první objevil, že jediné látky, které mohou ovlivnit platinu v vivo- jedná se o "královskou vodku" (směs koncentrované kyseliny chlorovodíkové a sírové nebo kyseliny dusičné), stejně jako tekutý brom.
Ukládání a těžba platiny.
První platinový vklad objevený před mnoha staletími kmeny Inků v Jižní Americe a až do 19. století byl jediným známým zdrojem platiny na světě. V roce 1819 byla platina objevena v Ruské říši, na území současnosti Krasnojarské území na Sibiři. Po dlouhou dobu nebyl tento ušlechtilý kov identifikován a byl označován jako „ bílé zlato nebo prostě "nový sibiřský metal". Plnohodnotná těžba platiny v Rusku začala koncem první poloviny 19. století – vynálezem tehdejších ruských vědců nová metodika kování platiny za tepla.
V naší době se jihoamerická ložiska v Andách začala vyčerpávat a hlavní perspektivní oblasti těžba platiny nachází se na území pouze pěti států:
- Rusko (Ural a Sibiř);
- Čína;
- Zimbabwe.
V 19. a na samém počátku 20. století se Ruské impérium stalo hlavním dodavatelem platiny na světový trh – 90 až 95 procent všech dodávky platiny. To pokračovalo, dokud tento ušlechtilý kov nebyl přeceněn a nezískal strategický význam. Jakkoli se tak stalo ve druhé polovině 19. století (v té době byly všechny vydané platinové mince v Rusku staženy z oběhu za vlády Pavla I. a Mikuláše I.), dodávky platiny do Evropy pokračovaly i za Alexandra II. Již v dobách Sovětského svazu byly všechny údaje o těžbě platiny přísně utajovány a zůstávají tak dodnes – již v Ruské federaci. Proto hodnocení Ruska jako 3. nebo 4. země podle těžba platiny ve světě, je velmi podmíněné. A nikdo ani přibližně neví, kolik platiny je uloženo ve strategických rezervách Ruské federace.
Na tento moment s jistotou je známo pouze to, že lídrem v těžbě platiny v Rusku je státní společnost Norilsk Nickel. Oficiálně publikovaná produkce tohoto kovu v roce 2000 činila v průměru asi 20-25 tun platiny ročně. Jihoafrická republika zároveň dodává na mezinárodní trh zhruba 150 tun ročně. Již v naší době bylo na území Chabarovska objeveno nové ložisko platiny (poměrně velké ložisko), ale jeho oficiální produkce je pouze 3 až 4 tuny ročně.
Aktuálně objevená ložiska platina na světě naznačují potenciální produkci asi 80 tisíc tun tohoto kovu. Většina z nich se nachází v Jižní Africe (více než 87 procent). V Rusku - více než 8%. A ve Státech - až 3%. Opět jde o oficiálně zveřejněná data. Nezapomeňte, že ne každá země chce zveřejnit obsah svých strategických skladovacích zařízení. drahé kovy a těžební potenciál.
Aplikace platiny.
Platina, stejně jako většina platinoidů, má stejné použití:
- klenotnický průmysl;
- zubní lékařství;
- chemický průmysl (kvůli katalytickým vlastnostem);
- elektronika a elektrotechnika;
- lékařství (nádobí a nástroje);
- léčiva (léky, zejména onkologické);
- kosmonautika (téměř věčné pájení platinových kontaktů nevyžaduje opravu);
- výroba laserů (platina je součástí většiny zrcadlových prvků);
- galvanické pokovování (například nekorozivní části ponorek);
- výroba teploměrů.
Ceny a dynamika cen platiny.
Zpočátku platinová cena(když byla přivezena do Evropy v 17. století) byla velmi nízká. Přes krásu nového kovu se nedal nikde roztavit a správně použít. V začátek XVIII století, kdy technologie umožnila jeho roztavení, padělatelé začali používat platinu k padělání zlatých španělských realů. Poté španělský král zabavil téměř všechnu platinu a slavnostně ji zaplavil ve Středozemním moři a zakázal další dodávky.
Celou tu dobu platinová cena nepřesáhla polovinu ceny stříbra.
S rozvojem nových technologií v začátek XIX století a s izolací čisté platiny firmou Wollaston se platina začala používat v různých odvětvích a její cena dosáhla ceny zlata.
Ve dvacátém století, po uvědomění si výhod platiny ve fyzických a chemické vlastnosti ach ve srovnání se zlatem jeho cena stále rostla. Poptávka po platině jako vysoce kvalitním chemickém katalyzátoru vzrostla v 70. letech, kdy začal světový boom v automobilovém průmyslu. Tento ušlechtilý kov se používal k čištění výfukových plynů (obvykle ve slitině s jinými platinoidy). Tehdy chemici zjistili, že v jemně rozptýleném stavu (tj. atomizované formě) platina aktivně interaguje s vodíkovou složkou (CH) výfukových plynů spalovacích motorů.
Finanční poklesy a krize v letech 2000 a 2010 ovlivnily poptávku a dynamika cen platiny. Během tohoto období (zejména v roce 2000) klesly ceny platiny pod tisíc dolarů (téměř 900 dolarů) za trojskou unci drahého kovu. V posledních 10 letech byla cena unce platiny pod 1 000 USD považována za nerentabilní. Není proto divu, že některé těžařské (hlavně jihoafrické) podniky, které těží platinu, skončily. Kvůli tomu byl v roce 2010 v poměru nabídky a poptávky u platiny určitý nedostatek „bílého zlata“ a jeho cena opět vyskočila. Pokles výroby čínských aut v letech 2014-2015 však způsobil nový pokles cen platiny.

Průměrná cena za unci platiny se v první polovině roku 2015 pohybovala kolem 1 100 USD. Odborníci však mají své předpověď ceny platiny. Podle jejich názoru v roce 2016 poroste úroveň světové ekonomiky a Čína obnoví velkovýrobu automobilů a cena za trojskou unci platiny přesáhne nejméně 1 300 dolarů a další platinový kov - palladium - bude stát více než 850 dolarů za trojskou unci.
Navíc skutečnost, že Ruská Federace stále drží tajemství rezervy platiny, znamená, že tento kov má vyhlídky na růst, a proto si zaslouží pozornost pro dlouhodobé investice (nebo alespoň udržení svých finančních zdrojů).
Platina je vzácný, lesklý kov stříbrné barvy. Mezi ostatními drahými kovy zaujímá zvláštní místo, je obvykle dražší než zlato a stříbro.
Je to dáno tím, že těžba platiny je extrémně pracný proces a tento kov je velmi vzácný. Například k získání jedné unce zlata stačí zušlechtit tři tuny rudy a k vytěžení podobného množství platiny je potřeba zpracovat až deset tun horniny.
Historie použití kovů
Platina je známá již před naším letopočtem. Byla použita v Starověký Egypt vyrábět různé šperky. Bylo to běžné i mezi kmeny Inků, ale časem se na to zapomnělo. Na fotografii můžete vidět platinové předměty objevené archeology:
Až po dlouhé době se o objev této látky zasloužili španělští cestovatelé, kteří prozkoumávali Jižní Ameriku. Zpočátku to nebylo oceněno, jak název napovídá. „Platina“ ve španělštině lze formulovat jako „malé stříbro“.
V souladu s tím byla platina ceněna mnohem méně než drahé kovy. Často se dokonce považovalo za nezralé zlato nebo špatné stříbro (kvůli barvě) a jednoduše se vyhodilo. Vyznačuje se žáruvzdorností a vysokou hustotou. Proto byl považován za nevhodný pro jakékoli použití.
Později však byla objevena zajímavá vlastnost – tento drahý kov má schopnost snadno se fúzovat se zlatem. Klenotníci to vzali v úvahu a aktivně začali přimíchávat platinu do zlatých předmětů, čímž snížili náklady na jejich výrobu. Navíc to bylo provedeno tak obratně, že bylo téměř nemožné odhalit padělek. Díky vysoké hustotě platiny zvyšoval i její malý objem hmotnost. dokončený produkt, ale to bylo kompenzováno přidáním určitého množství stříbra do slitiny, což neovlivnilo barvu. Takový podvod byl nicméně rozpoznán a dovoz drahého kovu do Evropy byl na nějakou dobu zákonem zakázán.
Jako nezávislý chemický prvek byla platina rozpoznána až v polovině osmnáctého století. Pečlivé studium jeho kvalit umožnilo nalézt první využití tohoto kovu.
Fyzikální a provozní vlastnosti platiny, zejména odolnost vůči různým vlivům a vysoká hustota, posloužily jako základ pro výrobu užitečného zařízení z ní. Zejména platinové retorty byly úspěšně používány pro zahušťování žíravé kyseliny sírové.
Takové nádoby se původně vyráběly kováním nebo lisováním, protože v té době vědecký pokrok nedokázal zajistit požadovanou teplotu v pecích pro tavení. Koncem devatenáctého století bylo možné roztavit platinu za použití plamene, který vzniká při spalování výbušného plynu.
Platina v Rusku
Historie tohoto ušlechtilého kovu v Rusku sahá až do roku 1819, kdy byl poprvé nalezen na Uralu, nedaleko Jekatěrinburgu. O pět let později byla v okrese Nižnij Tagil nalezena ložiska platiny. Placers se ukázalo být tak hojné, že se Rusko rychle stalo lídrem ve výrobě po celém světě.
Na fotografii můžete vidět největší nugget těžený na těchto ložiskách:
Jeho hmotnost byla 12 kg (bohužel později roztaven).
Uralská platina byla aktivně nakupována zahraničními společnostmi, export vzrostl zejména poté, co byla vyvinuta průmyslová metoda pro její čištění od nečistot a vytváření čistých stříbrných ingotů. Zpočátku byla velmi žádaná v zahraničí v Anglii a Francii, později se k nim přidaly USA a Německo.
V procesu výzkumu vědci objevili některé prvky, které tvoří nativní platinu. Palladium a rhodium jako první doplnily Mendělejevovu periodickou tabulku, později bylo izolováno iridium a osmium. A posledním prvkem v platinové skupině bylo ruthenium, objevené v roce 1844.
Vzhledem k tomu, že objemy platiny těžené na Uralu byly extrémně vysoké a většina kovu prostě nenašla hodné využití, bylo v roce 1828 rozhodnuto o vydání platinových mincí. Na fotografii jsou první ruské mince vyrobené z tohoto drahého kovu.
V té době již byl nalezen způsob výroby různých vysoce kvalitních produktů. Tato metoda, nazývaná prášková metalurgie, je dnes široce používána. V současné době mají ruské platinové mince 19. století obrovskou hodnotu. Cena jedné kopie může dosáhnout až 5000 amerických dolarů.
Pro výrobu šperků se většina vytěžené platiny používala až do poloviny dvacátého století, poté se začala častěji využívat pro technické účely. Používá se v následujících odvětvích:
- Automobilový průmysl (pro výrobu katalyzátorů);
- Elektrotechnika (tvorba prvků pro elektrické pece vystavené vysokým teplotám);
- Petrochemická a organická syntéza;
- Syntéza amoniaku.
Používá se také při výrobě dílů sklářských tavicích pecí, různých laboratorních zařízení, zařízení pro průmysl, kde je nutná odolnost proti chemickým a tepelným vlivům.
Základní vlastnosti
Často můžete slyšet názor, že platina a bílé zlato jsou jedno a totéž. Ale ve skutečnosti je takové tvrzení zásadně špatné, jsou si podobné pouze v barvě.
Platina je chemický prvek periodické tabulky (přirozená klasifikace prvků podle elektronové struktury atomů), s vlastní charakteristické vlastnosti. Ačkoli fotografie ukazuje určitou podobnost s bílým zlatem ve vzhledu.
Jde o drahý kov stříbrné barvy, ale přesto vypadá trochu jinak než stříbro. Od ostatních se liší také svými vlastnostmi a způsoby aplikace.
Fyzikální a chemické vlastnosti platiny
Tento prvek je žáruvzdorný kov s vysokou hustotou, pro jeho roztavení je nutná teplota 1769 stupňů Celsia a pro var - 3800 stupňů kvůli nízké tepelné vodivosti.
Je to také jeden z nejtěžších kovů v periodické tabulce. Podle tohoto ukazatele jej překonávají pouze dva další prvky skupiny platiny - osmium a iridium. Hustota za normálních podmínek je 21,45 gramů na čtvereční decimetr. Měrná hmotnost je 21,45 gramů na centimetr krychlový. Tento ukazatel je vyšší než u zlata a je téměř dvojnásobkem specifické hmotnosti stříbra.
Tvrdost platiny je další kvalitou, díky které je užitečná v průmyslu a šperkařství. Odolnost vůči různým vnějším vlivům činí proces zpracování a výroby produktů pracnějším, ale jeho provozní vlastnosti tyto nepříjemnosti více než kompenzují.
Například šperky mohou být vyrobeny výhradně z čisté platiny, zatímco zlato a stříbro vyžadují pro zajištění pevnosti nečistoty v jiných materiálech.
Za zmínku také stojí vysoká tažnost tohoto kovu. Z něj můžete vyrobit ten nejtenčí plát fólie popř světelný drát bez ztráty základních vlastností.
Platina patří do skupiny ušlechtilých kovů, jelikož nemá schopnost oxidovat a odolává korozi. Vysoká inertnost kovu neumožňuje interakci s kyselinami nebo zásadami. Může být rozpuštěn pouze v "aqua regia" a kapalném bromu, podléhající rozpuštění při dlouhodobém vystavení horké kyselině sírové.
Při zahřívání této látky se zvyšuje možnost interakce s jinými látkami. chemické prvky, látky a slitiny. Zvýšení teploty umožňuje získat oxid platiny, který se tvoří na povrchu kovu. Existuje několik jeho odrůd, které jsou snadno rozlišitelné podle barvy.
Nejznámější jsou:
- Černý PtO (tmavě šedý);
- oxid platiny PtO2 (hnědý);
- Oxid PtO3 (červenohnědý).
Rychlost a stupeň oxidace tohoto kovu přímo závisí na tom, jak volně kyslík vstupuje na povrch a jaký je jeho tlak. Jiné kovy nacházející se na povrchu platiny mohou sloužit jako překážka oxidace. Největší oxidaci je proto třeba očekávat u čistého kovu bez jakýchkoliv nečistot.
V závislosti na konkrétní sloučenině může platina vykazovat různé oxidační stavy. Tento indikátor se pohybuje od 0 do +8.
S poměrně nízkým odporem je tento kov dobrým vodičem, v této vlastnosti je horší než hliník, měď a stříbro. Index měrného odporu se blíží indexu odporu železa.
V souladu s tím zaujímá specifická vodivost platiny (převrácená hodnota měrného odporu) podobnou pozici mezi ostatními prvky periodické tabulky. Jelikož se jedná o vodič, jeho odpor se při zahřívání zvyšuje, zatímco jeho vodivost naopak klesá. Tato vlastnost je způsobena skutečností, že částice ve složení platiny se začínají chaoticky pohybovat s rostoucí teplotou. A to zase vytváří překážky pro průchod elektrického proudu.
Jednou z nejdůležitějších vlastností, která je široce používána ve výrobě, je vlastnost tohoto ušlechtilého kovu působit jako katalyzátor mnoha chemických reakcí. Obvykle se používá ve slitině s rhodiem nebo jako platinová čerň - jemný prášek charakteristické černé barvy, získaný v důsledku redukce sloučenin.
Platinové odporové teploměry jsou nyní poměrně rozšířené (ilustrováno na fotografii). To je způsobeno skutečností, že tato látka prakticky nepodléhá korozi, má vysoký stupeň tažnost, inertnost a umožňuje použít k výrobě čistý kov. Důležitou roli hrají takové vlastnosti, jako je vysoký odpor a významný teplotní koeficient odporu.
Závěr
Většina lidí si pod pojmem platina představí velmi drahý stříbřitě bílý kov, který se používá k výrobě šperků. Pro své četné vlastnosti se však rozšířil v různých oborech lidské činnosti, od lékařství až po automobilový průmysl.
Přestože platina nebyla nikdy v celé své historii použita jako peníze, investice do platiny je považována za poměrně výhodnou investici. Jedna unce tohoto kovu převyšuje cenu podobného množství zlata o 270 dolarů. Pokud budete neustále sledovat kurz drahých kovů, můžete získat dobrý zisk.
Asi první asociací se slovem „platina“ bude něco jako platina snubní prsten nebo jakékoli drahé diamantové šperky. V krajním případě platinová pamětní mince, případně investiční vklad. Nicméně, v reálný život situace je jiná. Platina je tedy jedním z těch drahých kovů, jejichž použití v průmyslu je běžnější než použití pro šperkařské účely.
Na základě údajů USGS 2012
Platinové automobilové katalyzátory
Jak je vidět z výše uvedeného diagramu, platina se v současnosti používá hlavně v automobilových katalyzátorech. Díky svým jedinečným katalytickým vlastnostem se platina (stejně jako rhodium) používá k čištění výfukových plynů automobilů od škodlivých látek.
Katalyzátorem je válec s kruhovým nebo eliptickým průřezem, uvnitř kterého jsou kovové nebo keramické plástve potažené roztokem chemikálií a kovů platinové skupiny. Voštinová struktura se používá ke zvětšení kontaktní plochy výfukových plynů s reakčním povrchem. Katalyzátor je instalován uvnitř nádoby z nerezové oceli - celá tato sestava se nazývá katalyzátor automobilu a je instalována na autě mezi motor a tlumič výfuku.

Výfukové plyny vozidel obsahují značné množství škodlivých sloučenin, které lze katalyzátorem přeměnit na relativně bezpečné. Hlavními znečišťujícími látkami výfukových plynů jsou:
oxid uhelnatý (CO), což je jedovatý plyn
oxidy dusíku (NOx), které přispívají ke vzniku kyselých dešťů, ničí ozón, tvoří smog a způsobují dýchací potíže
uhlovodíky (HC), které tvoří smog a mají zápach
- částice nesoucí karcinogenní sloučeniny.
Automobilové katalyzátory přeměňují více než 90 % škodlivých sloučenin ve výfukových plynech benzínových motorů na neškodný oxid uhličitý (CO2), dusík (N2) a vodní páru (H2O). Autokatalyzátory také přeměňují více než 90 % emisí vznětových motorů ve formě oxidu uhelnatého, uhlovodíků a pevných částic na oxid uhličitý a vodní páru.
Poprvé na legislativní úrovni bylo povinné používání katalyzátorů pro automobilky zavedeno v roce 1975 v USA a Japonsku. Následovaly další země s rozvinutým automobilovým trhem - Jižní Korea (1987), Mexiko (1989), členské státy Evropské unie (1993), Brazílie (1994), Rusko (1999) a Čína a Indie (2000). V Rusku se používá evropská norma Euro, od 1. ledna 2013 musí všechny nové vozy splňovat normu Euro-4. V samotné Evropě je v současné době v platnosti norma Euro-5, přechod na Euro-6 je naplánován na rok 2015.
Je jasné, že používání platiny a kovů platinové skupiny jako součásti automobilových katalyzátorů bude v blízké budoucnosti jen narůstat, protože se budou nadále zpřísňovat emisní normy znečišťujících látek.
Platinové šperky
Ve většině zemí, kde se šperky vyrábí, se používají slitiny platiny s obsahem čistého kovu minimálně 85 %. K platině se přidávají další kovy ze skupiny platiny, jako je palladium, ruthenium a iridium, stejně jako měď a kobalt, aby se zlepšila její obrobitelnost a odolnost proti opotřebení.
Hlavní výhodou platiny jako šperkového materiálu je její pevnost, stejně jako stálost lesku a barvy. Lze jej opakovaně ohřívat a chladit bez ztráty svých vlastností a bez známek oxidace. Dokonce i ty nejtenčí části platiny nemění svou velikost, což umožňuje návrhářům bezpečně osadit diamanty nebo jiné kameny. To dává klenotníkům značnou tvůrčí svobodu, někdy nedostupnou s jinými materiály.
Možná, nejlepší příklad virtuózní technikou využití vlastností platiny jsou produkty, kde drahokamy jsou drženy na místě pouze napětím kroužku.

Historie šperků platiny není tak velká
Indické civilizace Jižní Ameriky začaly používat platinu k výrobě šperků asi před 2000 lety pomocí nugetů nalezených v korytech řek. Na jiných kontinentech však platina dlouho nebyla známá (nebo spíše nevnímala, mylně ji považovali za „špatné“ stříbro) a ve šperkařství se začala používat poměrně nedávno.
Moderní tradice platinových šperků pochází od evropských dvorních klenotníků 18. století a rozvíjí se v dílech předních edwardiánských a art deco šperkařů jako např. Cartier A Tiffany . Po Evropě ve 20. letech 20. století přišel boom šperků do Spojených států. Ale s nástupem Velké hospodářské krize a poté druhé světové války, kdy se platina stala válkou kontrolovaným materiálem, zájem klenotníků o ni vyprchal.
Poptávka po platině začala v Japonsku ožívat v 60. letech 20. století. Platina získala v Japonsku zvláštní status, spojuje vysokou čistotu, prestiž a hodnotu s tradiční japonskou skromností a cudností, které jsou v Japonsku označovány bílou – barvou platiny. Japonsko se rychle stalo hlavním světovým trhem pro platinu šperky.
V Evropě začala renesance platiny v Německu v 70. letech 20. století, kde klenotníci dali platinovým kouskům jejich vlastní identitu pomocí zcela nových designů a povrchových úprav ve vysokém lesku. Poptávka po platině začala v 80. letech stoupat v Itálii a v 90. letech ve Švýcarsku, USA a Velké Británii. Do roku 1995 poptávka po platině v Číně výrazně vzrostla, zejména mezi mladými městskými ženami, kterým vyhovoval nový moderní styl platinových šperků. Čína v současnosti spotřebovává až 70 % veškeré platiny používané při výrobě šperků a je také největším trhem pro platinové šperky. V posledním desetiletí také výrazně vzrostl zájem o platinu na indickém trhu, který má významný potenciál růstu.
Investice do platiny
Platina a palladium jsou hmotným majetkem, který má zvláštní soubor fyzikálních a chemických vlastností – nepodléhá vlivu času. Stejně jako zlato a stříbro jsou platina a palladium přijímány jako univerzální prostředek směny díky mezinárodní standardizaci jejich formy a čistoty. Platinu lze koupit jako fyzický materiál (slitky, mince) a v neosobní podobě - speciální kovové bankovní účty. Popularitu získávají také různé burzovně obchodované instrumenty (ETF) spojené s kotacemi platiny na trhu.

V roce 2012 bylo celosvětově nakoupeno pro investiční účely více než 14 tun platiny a stejné množství palladia.
Platina v chemickém a ropném průmyslu
Kovy skupiny platiny se používají v chemickém průmyslu jako katalyzátory pro zvýšení účinnosti reakcí.
Platina je široce používána jako katalyzátor při výrobě kyseliny dusičné, která je surovinou pro výrobu dusíkatých hnojiv a dalších látek.
Platinové katalyzátory se také používají při výrobě různých silikonů. Přídavek platiny do silikonové směsi katalyzuje „zesíťování“ silikonových struktur, což umožňuje získat materiál s požadovanými vlastnostmi. Silikon je velmi odolný materiál s vynikající odolností proti chemické korozi, teplu a teplotním extrémům. Silikony jsou také velmi flexibilní, voděodolné a elektricky izolující materiály. Rozsah jejich použití je extrémně široký – od dílů leteckých motorů až po lékařské a kosmetické materiály. Je zřejmé, že v budoucnu budou silikony používány stále více a v souladu s tím poroste poptávka po platině v tomto odvětví.
Platinové katalyzátory se používají v rafinériích k výrobě benzinu a petrochemických surovin, které jsou základem pro výrobu plastů, syntetického kaučuku a polyesterových vláken. Ropa dodávaná do rafinérií je směsí uhlovodíků, které patří mezi těžké a lehké frakce. Poměr frakcí závisí na regionu výroby, ale obecně je více těžkých frakcí, zatímco lehká frakce se používá k získání benzinu a kvalitních surovin pro další zpracování. Proto je jedním z hlavních úkolů rostlin přeměna těžkých frakcí na lehké. Toho je dosaženo prostřednictvím složitého vícestupňového procesu destilace oleje.
Platina se podílí na destilačních krocích, jako je reformování a izomerizace, jejichž výsledkem jsou vysokooktanové složky pro benzín. Pro reformování a izomeraci se používají katalyzátory ve formě kuliček nebo granulí oxidu hlinitého potažených platinou. Hmotnost čisté platiny není větší než 0,6 % hmotnosti katalyzátoru. Ve většině moderních továren se platina kombinuje s cínem nebo rheniem, aby se zvýšila produktivita. Platina je klíčem k rafinaci ropy, bez ní by byl tento proces neúčinný.

Na počátku byla rafinace ropy jednou z hlavních oblastí průmyslové spotřeby platiny. Zdokonalování technologií a samotných katalyzátorů ale vedlo k tomu, že se spotřebovává stále méně platiny, a to i přes rostoucí počet kapacit na rafinaci ropy. Objem spotřeby platiny pro tuto oblast průmyslu nedochází k drastickým změnám.
Další použití platiny
Zařízení na výrobu platinového skla
Při výrobě se používá platinové zařízení různé typy sklo, protože odolává teplotám používaným při výrobě skla (až 1700 °C) a abrazivnímu působení roztaveného skla. Platinové zařízení nereaguje s roztaveným sklem, neoxiduje a nedeformuje se při vysokých teplotách.
Platina v medicíně
V určitých chemických formách může platina inhibovat dělení živých buněk. Této vlastnosti se využívají léky, které pomáhají při léčbě rakoviny – karboplatina, cisplatina, oxaliplatina.
Inertnost platiny vůči jakýmkoliv sloučeninám, její elektrická vodivost a nealergizovatelnost umožňuje její aktivní využití v biomedicíně jako součást elektrických stimulátorů, katétrů a dalších lékařských přístrojů.

Platinové měřidla a zapalovací svíčky
Platina je součástí senzorů používaných v různých průmyslových odvětvích. Nejznámější je kyslíková neboli „lambda“ sonda, která zajišťuje správné proporce směšování vzduchu a paliva ve válcích motorů automobilů. Platina se také používá v automobilových senzorech hmotnostního průtoku vzduchu, klimatizačních systémech a airbagech.
Automobilové a letecké motory navíc používají zapalovací svíčky, jejichž elektrody jsou potaženy platinou a iridiem pro zvýšení životnosti zapalovací svíčky.
Palivové články jsou budoucností platiny
V budoucnu může spotřeba platiny vzrůst se zahájením hromadné výroby palivových článků, kde je součástí podstatná součást- membrány. Palivové články jsou potenciální alternativou spalovacích motorů s vyšší účinností a nulovými emisemi.
Platina v leteckém průmyslu
Platina se používá k nátěru lopatek turbín v plynových (proudových) motorech, aby se zvýšila jejich odolnost v agresivním plynném prostředí.
Vzhledem k tepelné odolnosti a chemické odolnosti platiny se platinové sklo používá v laboratořích pro zvláště přesná a náročná měření.
