Porušení koncentrační funkce ledvin. Funkční testy při hodnocení koncentrační funkce ledvin
Přečtěte si také
Strukturální jednotkou ledvin je nefron, který je zodpovědný za proces filtrace krve. Ve dvou močových orgánech se shromažďují asi dva miliony nefronů, které jsou ve skupinách spleteny do malých kuliček. Jedná se o glomerulární aparát (glomerulární), ve kterém dochází ke glomerulární filtraci ledvin.
Důležité: během dne projde glomeruly nefronů 120 až 200 litrů krve. Přitom právě v nefronech dochází k oddělení všech toxinů a produktů rozpadu bílkovin, sacharidů a tuků.
Princip filtračního procesu
Proces filtrace ledvin je poměrně jednoduchý a přímočarý. Nejprve krev obohacená kyslíkem a dalšími živinami vstupuje do ledvin, konkrétně do glomerulárního aparátu. V nefronech, které mají jakési „síto“, dochází k oddělování toxických látek a dalších produktů rozpadu z vody. Po takovém rozdělení se voda a užitečné stopové prvky (glukóza, sodík, draslík) vstřebávají zpět. To znamená, že probíhá proces reabsorpce. A všechny toxiny pokračují ve svém pohybu nefronovými tubuly do renálních pyramid a dále do pyelocaliceálního systému. Zde se již tvoří sekundární moč, která odchází močovodem, močovým měchýřem a močovou trubicí.
Důležité: stojí za to vědět, že pokud jsou ledviny člověka nemocné, nefrony v nich pomalu umírají jeden po druhém. Postupně se tak snižuje filtrační funkce močových orgánů. Je třeba mít na paměti, že nefrony, stejně jako nervové buňky, nelze obnovit. A ty nefrony, které přijímají dvojnásobnou a trojnásobnou zátěž, nakonec přestanou zvládat svou funkci a brzy selžou.
Faktory, které mohou ovlivnit změnu GFR

Rychlost filtrace v glomerulárním aparátu závisí na těchto faktorech:
- Rychlost transportu plazmy ledvinovým glomerulárním aparátem. To znamená, že to znamená objem krve procházející bederní arteriolou za určitou časovou jednotku. Normálně je toto číslo 600 ml / min pro osobu s průměrnou hmotností 70 kg.
- Indikátor tlaku v cévním systému těla. Normální a zdravé tělo se vyznačuje vyšším tlakem v přiváděcí nádobě než v nádobě odcházející. V opačném případě bude proces filtrace obtížný a jeho rychlost se sníží.
- Počet zdravých nefronů. Čím více je ledvina postižena patologickým stavem, tím menší je filtrační plocha. To znamená, že počet zdravých nefronů klesá.
odhad GFR
blockquoteblue>Důležité: Normálně se filtrace ledvin ve zdravých orgánech vyskytuje konstantní rychlostí a zůstává nezměněna až do vývoje patologických procesů v močových orgánech.
Patologie, které určují GFR

Patologické procesy, které mění rychlost glomerulární filtrace ledvin na nižší stranu, mohou být velmi různorodé. GFR je ovlivněna zejména těmito patologiemi a nemocemi:
- Chronické selhání ledvin. V tomto případě bude také zaznamenána zvýšená koncentrace kreatininu a močoviny v moči. To znamená, že ledviny nezvládají svou filtrační funkci.
- Pyelonefritida. Toto zánětlivé a infekční onemocnění postihuje především nefronové tubuly. A teprve potom dochází k poklesu GFR.
- Diabetes. A také s hypertenzí (vysokým krevním tlakem), lupus erythematodes, je pozorována zvýšená rychlost procesu filtrace ledvin.
- Hypotenze (nízký krevní tlak). Stejně jako šokový stav a srdeční selhání může vyvolat pokles GFR na významné limity.
Pomoc při diagnostice nemocí

Měření GFR umožňuje identifikovat různá onemocnění a patologické stavy v raném stádiu. Současně se pro sledování filtračního procesu v ledvinách často používá metoda zavádění inulinu do krve, speciální kontrolní látky, která se vylučuje glomerulárním aparátem. Inulin je podáván nepřetržitě po dobu trvání studie, aby se udržela konstantní koncentrace v krvi.
Odběr vzorků moči pro analýzu při zachování hladiny inulinu se provádí čtyřikrát s půlhodinovým intervalem. Ale stojí za to vědět, že tato metoda analýzy stavu ledvin je poměrně komplikovaná a je použitelná výhradně pro vědecké účely.
GFR je také možné odhadnout podle úrovně clearance kreatininu, která přímo závisí na tělesné hmotnosti pacienta. Zde stojí za to vědět, že u aktivních mužů je clearance kreatininu výrazně vyšší než u žen a dětí. Všimněte si, že kreatinin opouští tělo výhradně přes glomerulární aparát. Pokud je tedy narušen filtrační proces v ledvinách, koncentrace kreatininu v moči stoupá a činí 70 % ve srovnání s GFR.
Důležité: při provádění testu moči na kreatinin to musíte vědět léky může výsledek značně zkreslit. Normálně je hladina kreatininu pro muže 18-21 mg / kg a pro ženy 15-18 mg / kg. Pokud jsou indikátory sníženy, může to znamenat poruchu funkce ledvin.

Tato technika pro studium práce močových orgánů se provádí tímto způsobem:
- Ráno je pacientovi nabídnuto vypít půl litru vody na lačný žaludek. Poté musí každou hodinu močit, aby shromáždil části biomateriálu do samostatných nádob.
- Při močení je pacient povinen poznamenat si čas začátku a konce úkonu.
- A v intervalu mezi odběrem porcí moči je pacientovi odebrána krev ze žíly pro stanovení clearance kreatininu. Vypočítává se pomocí speciálního vzorce. Výpočtový vzorec vypadá takto - F1=(u1/p)v1.
Zde jsou významy následující:
- Fi je glomerulární filtrace (její rychlost);
- U1 - obsah kontrolní látky v krvi;
- Vi - čas úplně prvního močení po napití vody (v minutách)
- p je koncentrace kreatininu v krevní plazmě.
Každou hodinu vypočítejte clearance kreatininu pomocí výše uvedeného vzorce. V tomto případě se výpočty provádějí během dne.
To je zajímavé: u normálních mužů je GFR 125 litrů / min a u žen - 110 ml / min.
Výpočet GFR u dětí

Pro výpočet rychlosti glomerulární filtrace u dětí použijte Schwartzův vzorec. V prvním případě se odebere vzorek krve ze žíly u malého pacienta nalačno. Je nutné stanovit hladinu kreatininu v krevní plazmě. Na pozadí biomateriálu odebraného miminku se také odebírají dvě porce moči v hodinovém intervalu. A také si všimněte doby trvání aktu močení v minutách nebo sekundách. Výpočty pomocí Schwartzova vzorce umožňují získat dvě hodnoty GFR.
U druhého způsobu výpočtu se denní objem moči shromažďuje od malého pacienta v hodinových intervalech. Zde by měl být objem alespoň 1,5 litru. Pokud je během výpočtů výsledek rychlosti glomerulární filtrace 15 ml / min (to znamená, že je výrazně snížen), znamená to selhání ledvin nebo chronické onemocnění ledvin.
Důležité: GFR nemusí vždy spadnout na pozadí nefronové smrti. Často se rychlost filtrace může snížit na pozadí zánětlivého procesu vyskytujícího se v ledvinách. Proto je při prvních podezřelých příznacích (bolesti zad, tmavá moč, otoky) naléhavé kontaktovat nefrologa nebo urologa.
Léčba ledvin a obnovení rychlosti filtrace
V případě porušení filtrační funkce ledvin by měla být léčba předepsána pouze odborníkem v závislosti na hlavní příčině, která vedla k patologii. Ve většině případů pomáhají zlepšit situaci léky "Theobromine" a "Eufillin". Zvyšují diurézu, což vede k normalizaci GFR.
Také na pozadí léčby je nutné dodržovat dietu a pitný režim. Vyplatí se vypít až 1,2 litru tekutin denně. A ze stravy by měly být vyloučeny všechny smažené, mastné, slané, kořeněné, uzené. Bude lepší, když pacient po dobu léčby přejde na dušená a vařená jídla.
Pokud to ošetřující lékař dovolí, pak můžete upravit rychlost glomerulární filtrace a lidové prostředky. Již dlouhou dobu je tedy známo, že petržel obecná, která zlepšuje diurézu, zvyšuje GFR. Jeho suchá semena a kořeny (v množství 1 polévková lžíce) se spaří vroucí vodou (500 ml) a inkubují se 2-3 hodiny. Poté se infuze filtruje a pije dvakrát během dne, každý 0,5 šálku.
Ke zvýšení GFR lze také použít šípkový kořen. Je v množství 2 polévkových lžic. zalijeme vroucí vodou a na mírném ohni vaříme 15 minut. Poté se vývar přefiltruje a opije 70 ml třikrát denně. Takový lék také zvyšuje diurézu, což určitě zvýší GFR.
Je důležité vědět, že celý proces léčby by měl řídit pouze odborník. Samoléčba je přísně zakázána.
lecheniepochki.ru
Filtrace krve v ledvinách
Abyste pochopili mechanismus čištění krve a tvorby moči, musíte mít představu o struktuře ledvin. Tento párový orgán se skládá z obrovského množství nefronů, ve kterých dochází k tvorbě moči.
Hlavní funkce ledvin jsou:
močení; Čištění krve, vylučování léků, metabolitů atd.; Regulace metabolismu elektrolytů; Kontrola tlaku a objemu cirkulující krve; Udržování acidobazické rovnováhy.
Ve skutečnosti jsou ledviny nepřetržitě fungující filtry, které zpracují až 1,2 litru krve za minutu.
Každá ledvina má tvar fazole. Na každé ledvině je jakási prohlubeň, které se také říká brána. Vedou do prostoru nebo sinusu naplněného tukem. Nachází se zde také pyelocaliceální systém, nervová vlákna a cévní systém. Ze stejné brány vystupte z žíly a tepny ledviny a také z močovodu.
Každá ledvina se skládá z mnoha nefronů, které jsou komplexem tubulů a glomerulů. K filtraci krve dochází přímo v ledvinovém tělísku nebo glomerulu. Zde se moč filtruje z krve a jde do močového měchýře.
Na videu struktura ledvin
Kde se děje
Ledvina je jakoby umístěna v pouzdru, pod kterým je zrnitá vrstva zvaná kůra a pod ní je dřeň. Dřeň se vyvíjí v ledvinové pyramidy, mezi nimiž jsou sloupce rozšiřující se směrem k ledvinovým sinusům. Na vrcholcích těchto pyramid jsou papily, které pyramidy vyprazdňují a přenášejí jejich obsah do malých pohárků a poté do velkých.
Počet kalichů se může u každého člověka lišit, i když obecně se 2-3 velké kalichy větví na 4-5 malých kalichů, přičemž jeden malý kalich nutně obklopuje papilu pyramidy. Z malého kalichu moč vstupuje do velkého kalichu a poté do močovodu a struktur močového měchýře.
Krev je přiváděna do ledvin renální tepnou, která se větví na menší cévky, dále se krev dostává do arteriol, které se dělí na 5-8 kapilár. Krev tedy vstupuje do glomerulárního systému, kde probíhá proces filtrace.
Schéma renální filtrace 
Glomerulární filtrace – definice
Filtrace v glomerulech ledvin probíhá podle jednoduchého principu:
Nejprve je tekutina vytlačena/filtrována z glomerulárních membrán pod hydrostatickým tlakem (≈125 ml/min); Poté přefiltrovaná kapalina prochází nefrony, většina z ní ve formě vody a nezbytných prvků se vrací do krve a zbytek se tvoří do moči; Průměrná rychlost tvorby moči je asi 1 ml/min.
Glomerulus ledvin filtruje krev a čistí ji od různých bílkovin. V procesu filtrace dochází k tvorbě primární moči.
Hlavní charakteristikou filtračního procesu je jeho rychlost, která je dána faktory ovlivňujícími činnost ledvin a celkový zdravotní stav člověka.
Rychlost glomerulární filtrace je objem primární moči vytvořený v renálních strukturách za minutu. Normální rychlost filtrace je 110 ml/min pro ženy a 125 ml/min pro muže. Tyto ukazatele fungují jako jakési měřítka, které podléhají korekci v souladu s hmotností, věkem a dalšími ukazateli pacienta.
Schéma glomerulární filtrace 
Porušení filtrace
Během dne nefrony přefiltrují až 180 litrů primární moči. Veškerá krev v těle má čas na to, aby ji ledviny 60x denně pročistily.
Některé faktory však mohou vyvolat narušení procesu filtrace:
snížení tlaku; poruchy močových cest; Zúžení tepny ledviny; Traumatizace nebo poškození membrány, která provádí filtrační funkce; Zvýšený onkotický tlak; Snížení počtu "pracovních" glomerulů.
Takové podmínky nejčastěji způsobují porušení filtrace.
Jak identifikovat porušení
Porušení filtrační aktivity je určeno výpočtem její rychlosti. Je možné určit, jak moc je filtrace omezena v ledvinách pomocí různých vzorců. Obecně se proces stanovení rychlosti redukuje na porovnání hladiny určité kontrolní látky v moči a krvi pacienta.
Obvykle se jako srovnávací standard používá inulin, což je polysacharid fruktózy. Jeho koncentrace v moči se porovnává s obsahem v krvi a následně se vypočítá obsah inzulinu.
Čím více inulinu v moči v poměru k jeho hladině v krvi, tím větší je objem filtrované krve. Tento ukazatel se také nazývá clearance inulinu a je považován za hodnotu purifikované krve. Jak ale vypočítat rychlost filtrace?
Vzorec pro výpočet rychlosti glomerulární filtrace ledvin je následující:
GFR (ml/min),
kde Min je množství inulinu v moči, Pin je obsah inulinu v plazmě, Vurine je objem konečné moči a GFR je rychlost glomerulární filtrace.
Aktivitu ledvin lze také vypočítat pomocí Cockcroft-Gaultova vzorce, který vypadá takto:
Při měření filtrace u žen je třeba výsledek vynásobit 0,85.
Poměrně často se v klinickém prostředí k měření GFR používá clearance kreatininu. Podobná studie se také nazývá Rehbergův test. V časných ranních hodinách pacient vypije 0,5 litru vody a okamžitě vyprázdní močový měchýř. Poté musíte každou hodinu močit, sbírat moč do různých nádob a zaznamenat dobu trvání každého močení.
Poté se vyšetří žilní krev a vypočítá se glomerulární filtrace pomocí speciálního vzorce:
Fi \u003d (U1 / p) x V1,
kde Fi je glomerulární filtrace, U1 je obsah kontrolní složky, p je hladina kreatininu v krvi a V1 je doba trvání studovaného močení. Podle tohoto vzorce se každou hodinu během dne provádí výpočet.
Příznaky
Známky poruchy glomerulární filtrace se obvykle redukují na změny kvantitativního (zvýšení nebo snížení filtrace) a kvalitativního (proteinurie) charakteru.
Mezi další funkce patří:
Tlaková ztráta; renální stáze; Hyperedém, zejména na končetinách a obličeji; Poruchy močení, jako je snížené nebo zvýšené nutkání, výskyt netypického sedimentu nebo barevné změny; Bolest v bederní oblasti Hromadění různých druhů metabolitů v krvi atd.
K poklesu tlaku obvykle dochází při šokových stavech nebo myokardiální insuficienci.
Příznaky poruchy glomerulární filtrace v ledvinách 
Jak zlepšit filtrování
Obnovení filtrace ledvin je nezbytné, zvláště pokud existuje přetrvávající hypertenze. Spolu s močí se z těla vyplavují přebytečné elektrolyty a tekutiny. Právě jejich zpoždění způsobuje zvýšení krevního tlaku.
Ke zlepšení funkce ledvin, zejména glomerulární filtrace, mohou odborníci předepisovat léky, jako jsou:
Theobromin je slabé diuretikum, které zvýšením průtoku krve ledvinami zvyšuje filtrační aktivitu; Eufillina je také diuretikum obsahující theofylin (alkaloid) a ethylendiamid.
Kromě užívání léků je nutné normalizovat celkovou pohodu pacienta, obnovit imunitu, normalizovat krevní tlak atd.
Pro obnovení funkce ledvin je také nutné jíst vyváženou stravu a dodržovat denní režim. Pouze integrovaný přístup pomůže normalizovat filtrační aktivitu ledvin.
Není špatná pomoc při zvýšení činnosti ledvin a lidové metody jako melounová dieta, odvar z divoké růže, diuretické odvary a bylinné nálevy, čaje atd. Ale než něco uděláte, musíte se poradit s nefrologem.
Glomerulární filtrace je jednou z hlavních charakteristik, které odrážejí činnost ledvin. Filtrační funkce ledvin pomáhá lékařům při diagnostice onemocnění. Rychlost glomerulární filtrace udává, zda dochází k poškození glomerulů ledvin a stupeň jejich poškození, určuje jejich funkčnost. V lékařské praxi existuje mnoho metod pro stanovení tohoto ukazatele. Pojďme se podívat, co je jejich podstatou a které z nich jsou nejúčinnější.

co to je?
Ve zdravém stavu má struktura ledviny 1-1,2 milionu nefronů (součástí ledvinové tkáně), které komunikují s krevním řečištěm prostřednictvím krevních cév. V nefronu dochází ke glomerulární akumulaci kapilár a tubulů, které se přímo podílejí na tvorbě moči – čistí krev od metabolických produktů a korigují její složení, to znamená, že filtrují primární moč. Tento proces se nazývá glomerulární filtrace (CF). Za den se přefiltruje 100-120 litrů krve.
 Schéma glomerulární filtrace ledvin.
Schéma glomerulární filtrace ledvin.
K hodnocení funkce ledvin se často používá glomerulární filtrace (GFR). Charakterizuje množství primární moči vyprodukované za jednotku času. Norma ukazatelů rychlosti filtrace je v rozmezí od 80 do 125 ml / min (ženy - do 110 ml / min, muži - do 125 ml / min). U starších lidí je míra nižší. Pokud má dospělý člověk GFR pod 60 ml / min, je to první signál těla o nástupu rozvoje chronického selhání ledvin.
Zpět na index
Faktory, které mění rychlost glomerulární filtrace ledvin
Rychlost glomerulární filtrace je určena několika faktory:
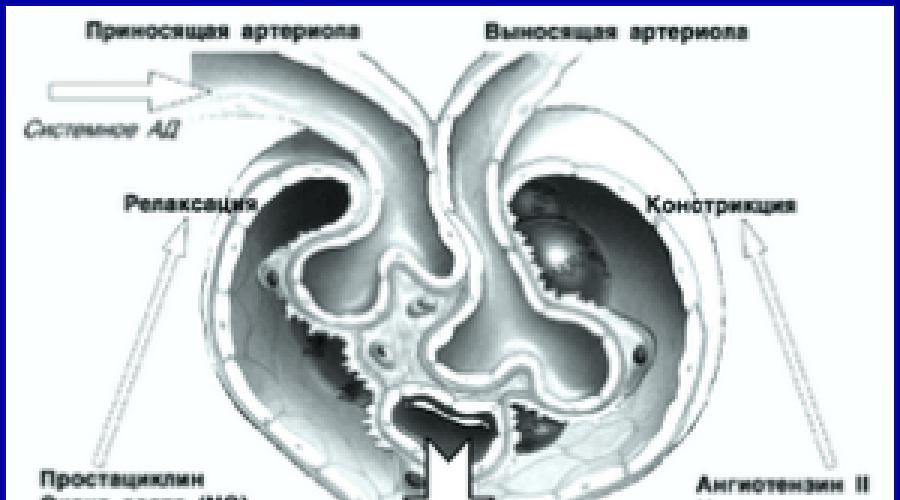
Rychlost průtoku plazmy v ledvinách je množství krve, které proteče za jednotku času aferentní arteriolou v ledvinovém glomerulu. Normální ukazatel, pokud je člověk zdravý, je 600 ml / min (výpočet byl proveden na základě údajů o průměrné osobě vážící 70 kg) Úroveň tlaku v cévách. Normálně, když je tělo zdravé, je tlak v aferentní cévě vyšší než v eferentní. Jinak k procesu filtrace nedochází Počet zdravých nefronů. Existují patologie, které ovlivňují buněčnou strukturu ledvin, v důsledku čehož se počet schopných nefronů snižuje. Takové porušení dále způsobuje zmenšení plochy filtračního povrchu, na jehož velikosti přímo závisí GFR.
Reberg-Tareevův test
 Spolehlivost vzorku závisí na době, kdy byla analýza shromážděna.
Spolehlivost vzorku závisí na době, kdy byla analýza shromážděna.
Reberg-Tareevův test zkoumá hladinu clearance kreatininu produkovaného tělem - objem krve, ze kterého je možné ledvinami odfiltrovat 1 mg kreatininu za 1 minutu. Kreatinin lze měřit ve sražené plazmě a moči. Spolehlivost studie závisí na době, kdy byla analýza shromážděna. Studie se často provádí následovně: moč se shromažďuje po dobu 2 hodin. Měří hladinu kreatininu a minutovou diurézu (objem moči, který se vytvoří za minutu). GFR se vypočítává na základě získaných hodnot těchto dvou ukazatelů. Méně používanou metodou je odběr moči za den a 6hodinové vzorky. Bez ohledu na to, jakou techniku lékař používá, pacient je sutra, dokud nesnídá, odebírá krev ze žíly, aby provedl studii clearance kreatininu.
Test clearance kreatininu je předepsán v těchto případech:
bolest v oblasti ledvin, otoky očních víček a kotníků, zhoršený výdej moči, tmavě zbarvená moč s krví, je nutné stanovit správnou dávku léků pro léčbu onemocnění ledvin, diabetes 1. a 2. typu, hypertenze břišní obezita, syndrom inzulinové rezistence; kouření; kardiovaskulární onemocnění; před operací; chronické onemocnění ledvin. Zpět na obsah
Cockcroftův-Goldův test

Cockcroftův-Goldův test také stanovuje koncentraci kreatininu v krevním séru, ale liší se od výše popsané metody pro sběr materiálů pro analýzu. Test se provádí následovně: ráno na lačný žaludek pacient vypije 1,5-2 sklenice tekutiny (voda, čaj), aby se aktivovala tvorba moči. Po 15 minutách pacient zmírní malou potřebu na toaletě vyčistit močový měchýř od zbytků formací během spánku. Další je mír. O hodinu později se odebere první vzorek moči a zaznamená se jeho čas. Druhá část se shromáždí v další hodině. Mezi tím pacient odebírá krev ze žíly v 6-8 ml. Dále se podle získaných výsledků stanoví clearance kreatininu a množství moči, které se vytvoří za minutu.
Zpět na index
Glomerulární filtrační rychlost podle vzorce MDRD
Tento vzorec zohledňuje pohlaví a věk pacienta, takže s jeho pomocí lze velmi snadno pozorovat, jak se ledviny s věkem mění. Často se používá k diagnostice dysfunkce ledvin u těhotných žen. Samotný vzorec vypadá takto: GFR \u003d 11,33 * Crk - 1,154 * věk - 0,203 * K, kde Crk je množství kreatininu v krvi (mmol / l), K je koeficient závislý na pohlaví (pro ženy - 0,742 ). V případě, že je tento ukazatel v závěru analýzy uveden v mikromolech (µmol / l), je třeba jeho hodnotu vydělit 1000. Hlavní nevýhodou tohoto způsobu výpočtu jsou nesprávné výsledky při zvýšené CF.
Zpět na index
Důvody poklesu a zvýšení ukazatele

Existují fyziologické důvody pro změny GFR. V těhotenství hladina stoupá, a když tělo stárne, klesá. Potraviny s vysokým obsahem bílkovin mohou také vyvolat zvýšení rychlosti. Pokud má člověk patologii renálních funkcí, pak se CF může zvýšit i snížit, vše závisí na konkrétní nemoci. GFR je nejčasnějším prediktorem poruchy funkce ledvin. Intenzita CF klesá mnohem rychleji, než se ztrácí schopnost ledvin koncentrovat moč a v krvi se hromadí dusíkaté odpady.
Při onemocnění ledvin je snížená filtrace krve v ledvinách vyvolána poruchami struktury orgánu: snižuje se počet aktivních strukturních jednotek ledvin, snižuje se ultrafiltrační koeficient, dochází ke změnám v průtoku krve ledvinami, snižuje se filtrační plocha dochází k obstrukci ledvinových tubulů. Je to způsobeno chronickými difuzními, systémovými onemocněními ledvin, nefrosklerózou na pozadí arteriální hypertenze, akutním selháním jater, závažným srdečním onemocněním, onemocněním jater. Kromě onemocnění ledvin je GFR ovlivněna extrarenálními faktory. Snížení rychlosti je pozorováno spolu se srdeční a cévní nedostatečností, po záchvatu těžkého průjmu a zvracení, s hypotyreózou, rakovinou prostaty.
Zvýšená GFR je méně častá, ale vyskytuje se, když cukrovka v časných stadiích hypertenze, systémový rozvoj lupus erythematodes, na počátku rozvoje nefrotického syndromu. Také léky, které ovlivňují hladinu kreatininu (cefalosporin a podobné účinky na tělo), jsou schopny zvýšit rychlost CF. Lék zvyšuje jeho koncentraci v krvi, takže při provádění analýzy jsou detekovány falešně zvýšené výsledky.
Zpět na index
zátěžové testy
 Proteinová zátěž je konzumace potřebného množství masa.
Proteinová zátěž je konzumace potřebného množství masa.
Základem zátěžových testů je schopnost ledvin vlivem určitých látek urychlit glomerulární filtraci. Pomocí takové studie se stanoví CF rezerva nebo renální funkční rezerva (RFR). K jeho rozpoznání se aplikuje jednorázová (akutní) nálož bílkovin či aminokyselin, případně se nahradí malým množstvím dopaminu.
Proteinová zátěž je změna stravy. Je nutné zkonzumovat 70-90 gramů bílkovin z masa (1,5 gramu bílkovin na 1 kilogram tělesné hmotnosti), 100 gramů rostlinných bílkovin nebo zadat aminokyselinovou sadu intravenózně. U lidí bez zdravotních problémů dochází k 20-65% zvýšení GFR již za 1-2,5 hodiny po podání dávky proteinů. Průměrná hodnota PFR je 20−35 ml za minutu. Pokud ke zvýšení nedojde, pak je s největší pravděpodobností u člověka narušena propustnost renálního filtru nebo se vyvinou vaskulární patologie.
Zpět na index
Význam výzkumu
Je důležité sledovat GFR u lidí s následujícími stavy:
chronický a akutní průběh glomerulonefritidy i její sekundární projev; selhání ledvin; zánětlivé procesy vyvolané bakteriemi; poškození ledvin v důsledku systémového lupus erythematodes; nefrotický syndrom; glomeruloskleróza; renální amyloidóza; nefropatie u diabetu atd.
Tato onemocnění způsobují pokles GFR dlouho před projevem jakýchkoli funkčních poruch ledvin, zvýšení hladiny kreatininu a urey v krvi pacienta. V zanedbaném stavu nemoc vyvolává potřebu transplantace ledviny. Proto, aby se zabránilo rozvoji jakýchkoli patologií ledvin, je nutné pravidelně provádět studie o jejich stavu.
no-gepatit.ru
Ultrafiltrace plazmy s tvorbou primární moči se provádí v glomerulech ledvin.
Filtrační membrána glomerulu se skládá ze tří vrstev: kapilární endotel, bazální membrána a epiteliální buňky vnitřní části pouzdra, které se nazývají podocyty. Podocyty mají procesy, které těsně spočívají na bazální membráně. Struktura bazální membrány je složitá, obsahuje zejména mukopolysacharidy a kolagenní protein. Permeabilita glomerulárního filtru v podstatě závisí na stavu bazální membrány, protože její otvory jsou nejmenší, řádově 5 nanometrů (podle Rouyeta).
Filtrační membrána glomerulu je schopna propustit téměř všechny látky přítomné v plazmě s molekulovou hmotností pod 70 000 a také malou část albuminů. Za určitých podmínek ledvinovým filtrem procházejí i větší molekuly bílkovin, např. antigeny bacilu tyfu a úplavice, viru chřipky, spalniček atd.
Glomerulární filtrace je určena filtračním tlakem (PD). Normální PD = 75-(25+10) = 40 mmHg Art., kde 75 mm Hg. Umění. - hydrostatický tlak v kapilárách glomerulů; 25 mmHg Umění. - onkotický tlak plazmatických proteinů; 10 mmHg Umění. - intrarenální tlak. Filtrační tlak se může měnit v rozmezí 25-50 mm Hg. Umění. Přibližně 20 % krevní plazmy protékající glomerulárními kapilárami je podrobeno filtraci (filtrační frakce).
§ 304 Index čištění (clearance)
Pro stanovení filtrační kapacity ledvin se používá definice purifikačního indexu. Ukazatelem pročištění neboli clearance (z anglického clear - to clear) je objem krevní plazmy, který se ledvinami zcela uvolní z této látky za 1 minutu. Clearance je určena odstraněním endogenních látek cirkulujících v krvi (například endogenního kreatininu) nebo odstraněním látek speciálně zavedených do krve (například inulinu atd.). Pro výpočet clearance potřebujete znát obsah látky v krvi (K), její obsah v moči (M) a minutovou diurézu (D) – množství moči uvolněné za 1 minutu. Světlost (C) se vypočítá podle vzorce:
Rychlost čištění není u různých látek stejná. Například průměrná clearance inulinu (polysacharidu) je 120 ml / min, močoviny - 70 ml / min, fenol rota - 400 ml / min atd. Tento rozdíl se vysvětluje tím, že inulin se vylučuje filtrací a není reabsorbovaná záda; močovina je filtrována, ale částečně reabsorbována a fenolrot je vylučován aktivní sekrecí v tubulech a částečně filtrován.
Pro stanovení skutečné filtrační kapacity glomerulů, tedy množství primární moči vytvořené za 1 minutu, je nutné použít látky, které se uvolňují pouze filtrací a nejsou zpětně absorbovány v tubulech. Patří mezi ně bezprahové látky, jako je inulin a hyposulfit. U dospělého je hodnota glomerulární filtrace (objem primární moči) v průměru 120 ml / min, tj. 150-170 l / den. Pokles tohoto indikátoru naznačuje porušení filtrační funkce ledvin.
§ 305. Účinnost průtoku krve ledvinami
Index clearance kyseliny para-aminohyppurové (PAH) umožňuje stanovit účinnost průtoku krve ledvinami. Tato látka se dostává do moči aktivní sekrecí a krev vytékající z ledvin PAH neobsahuje. Rychlost čištění PAG tedy odpovídá objemu krevní plazmy, která prošla cévami ledvin za 1 min. To se rovná průměru 650 ml / min. Objem krve, a nikoli plazmy, který prošel ledvinami, lze určit úpravou na hematokrit (normální objem červených krvinek je 45 %, plazmy – 55 %). Po vytvoření poměru se vypočte průtok krve ledvinami: 660 ml - 55%, X-100%, X = 1200 ml / min.
Je třeba vzít v úvahu, že clearance PAH není vždy adekvátní průtoku krve ledvinami. Koeficient clearance PAH se může snížit při nezměněném průtoku krve ledvinami, pokud jsou sekreční procesy narušeny v důsledku významného poškození tubulů (chronická nefritida, nefróza atd.).
Trvalý pokles účinnosti renálního průtoku krve se vyskytuje u hypertenze a také je rané znamení rozvíjející se renální arterioskleróza.
§ 306. Porušení glomerulární filtrace
Snížená filtrace. Pokles primární tvorby moči závisí na řadě extrarenálních a renálních faktorů. Tyto zahrnují:
- pokles krevního tlaku [ukázat]
- zúžení renální tepny a arteriol [ukázat]
- zvýšený onkotický krevní tlak [ukázat]
- obstrukce odtoku moči [ukázat]
- snížení počtu funkčních glomerulů [ukázat]
- poškození membrány filtru [ukázat]
Progresivní pokles počtu funkčních nefronů je typický pro chronické onemocnění ledvin s difuzním poškozením ledvin. Patří mezi ně chronická glomerulonefritida, arterioskleróza ledvin, pyelonefritida aj. Tato onemocnění jsou doprovázena sklerózou glomerulů a odumíráním nefronů, končící svraštěním ledviny. Při snížení počtu aktivních nefronů na 1/10-1/20 jejich normální velikosti se filtrace zastavuje, vzniká těžká urémie (viz § 314).
Zvýšení glomerulární filtrace vidět s:
- zvýšený tonus eferentní arteriole. Spasmus eferentní arteriole a zvýšení filtrace jsou zaznamenány se zavedením malých dávek adrenalinu (adrenální polyurie), v počáteční fázi hypertenze.
- snížený tonus aferentní arterioly. Tonus adduktorové arterioly se může reflexně snížit v důsledku omezení krevního oběhu na periferii těla, např. při horečce (zvýšená diuréza ve fázi vzestupu teploty).
- snížení onkotického krevního tlaku. Zvýšená filtrace v důsledku poklesu onkotického tlaku je zaznamenána při hojném podávání tekutin nebo v důsledku ředění krve (při ústupu edému).
§ 307. Porušení tubulární reabsorpce
Epiteliální buňky různých částí tubulů mají vysoce specializované funkce. Obsahují různé enzymy a nosné molekuly, které se podílejí na transportu látek z tubulů do krve (reabsorpce) a z krve do lumen tubulů (sekrece). Tyto procesy probíhají aktivně proti vysokému koncentračnímu gradientu a s velkým výdejem buněčné respirační energie.
Mezi nejčastější mechanismy zhoršené tubulární reabsorpce patří:
- přepětí procesů reabsorpce a vyčerpání enzymatických systémů v důsledku přebytku reabsorbovaných látek v primární moči;
- snížení aktivity enzymů tubulárního aparátu: a) dědičná vada enzymů, které zajišťují reabsorpci určitých látek nebo b) blokáda enzymů inhibitory;
- strukturální poškození tubulů (degenerace, nekrózy) při infekčních a zánětlivých procesech, poruchy prokrvení ledvin, zejména kortikální prokrvení a otravy jedy.
- Zhoršená reabsorpce glukózy [ukázat]
- Zhoršená reabsorpce bílkovin [ukázat]
- Zhoršená reabsorpce aminokyselin [ukázat]
- Zhoršená reabsorpce sodíku [ukázat]
- Porucha zpětného vstřebávání vody [ukázat]
§ 308. Porušení schopnosti ledvin koncentrovat a ředit moč
Lidské ledviny jsou schopny vylučovat moč 4x hypertonicky a 6x hypotonicky než plazma. Za normálních podmínek je koncentrace látek v konečné moči mnohonásobně vyšší než jejich koncentrace v plazmě (tab. 31).
Koncentrační schopnost ledvin lze posoudit podle relativní hustoty (měrné hmotnosti) moči. Ale tyto ukazatele se ne vždy shodují.
U zdravého člověka není relativní hustota moči při normální stravě nižší než 1,016-1,020 a pohybuje se v závislosti na příjmu vody a bilanci voda-sůl v rozmezí 1,002-1,035 nebo více. S věkem klesá osmotická koncentrace a relativní hustota moči.
Neschopnost ledvin koncentrovat moč se nazývá hypostenurie. Relativní hustota moči klesá na 1,012-1,006 a během dne mírně kolísá (obr. 77). Hypostenurie v kombinaci s polyurií ukazuje na poškození tubulárního aparátu ledvin s relativně dostatečnou funkcí glomerulů (časné stadium chronické nefritidy, pyelonefritidy). Hypostenurie v kombinaci s oligurií ukazuje na zapojení rostoucího počtu glomerulů do patologického procesu, v důsledku čehož vzniká málo primární moči.
Nebezpečnějším znakem poškození ledvin je izostenurie, kdy se relativní hustota moči blíží relativní hustotě glomerulárního filtrátu (1,010) a nemění se (monotonická diuréza). Izostenurie naznačuje porušení tubulární reabsorpce vody a solí, ztrátu schopnosti ledvin koncentrovat a ředit moč. V důsledku destrukce epiteliálních buněk se tubuly mění v jednoduché trubičky, které odvádějí glomerulární filtrát do ledvinné pánvičky. Kombinace izostenurie s oligurií je indikátorem těžké renální insuficience.
§ 309. Porušení tubulární sekrece
Při onemocněních ledvin mohou být narušeny sekreční procesy v tubulech a v krvi se hromadí všechny látky vylučované sekrecí, jako jsou antibiotika, kontrastní látky obsahující jód.
Zpoždění v krvi penicilinu a produktů jeho přeměn může mít toxický účinek na tělo. Při onemocnění ledvin je proto třeba penicilin, stejně jako některá jiná antibiotika, používat opatrně.
Porušení sekrece kyseliny močové se vyskytuje jako dědičná vada. Hromadění kyseliny močové a solí kyseliny močové v krvi vede k rozvoji tzv. ledvinové dny.
Zvýšená sekrece draslíku je zaznamenána při nadbytku hormonu aldosteronu a při užívání diuretik - inhibitorů enzymu karboanhydrázy. Ztráta draslíku (draselný diabetes) vede k hypokalémii a těžké dysfunkci.
Ledviny plní velmi cennou fyziologickou funkci udržování stálého pH krve. Tato funkce je spojena většinou s procesy acidogeneze a amoniogeneze.
| Acidogeneze - tvorba volných H + -iontů v tubulárních buňkách a jejich sekrece do lumen tubulů. Reakce probíhá za účasti enzymu karboanhydrázy (CO 2 + H 2 O karboanhydráza -> H 2 CO 3 -> H + + HCO - 3. Amoniogeneze je tvorba amoniaku a amonia. Zdrojem amoniaku jsou aminokyseliny, především glutamin. Dále se vytvoří amonný iont: NH 3 + H + -> NH 4. Sekrece iontů H + - vytváří podmínky pro reabsorpci sodíku a hydrogenuhličitanu a pro odstraňování kyselých produktů z těla ve formě titrovatelných kyselin. Vodíkové ionty vytěsňují sodík ze sloučenin s anionty slabých organických kyselin a z fosfátového pufru. Amonné ionty vytěsňují sodík ze sloučenin se silnými kyselinami. Sodík se vstřebává ve formě hydrogenuhličitanu a udržuje se alkalická rezerva krve a vyloučená moč je kyselá (pH moči je normálně 5,5-6,5, ale může se lišit v závislosti na povaze potravy od 4,5 do 7,8). |
Při porušení procesu acido- a amoniogeneze se ztrácí velké množství sodíku a hydrogenuhličitanů. V moči převládají alkalické fosforečnany (Na 2 HPO 4) místo kyselých (NaH 2 PO 4) a její reakce se stává zásaditou. Při ztrátě polovičního množství krevních bikarbonátů vzniká metabolická acidóza.
Příčiny poruchy acidogeneze a amoniogeneze jsou:
- dlouhodobé onemocnění ledvin s těžkým poškozením nebo atrofií tubulů;
- dědičný defekt v syntéze enzymových systémů, které zajišťují aktivní sekreci vodíkových iontů (renální tubulární acidóza);
- užívání některých diuretických léků - inhibitorů enzymu karboanhydrázy, jako je diakarb (předepsaný pod dohledem lékaře).
§ 310. Patologické složky moči při chorobách ledvin
až patologické základní části moč zahrnuje prvky, které se nenacházejí v moči zdravých lidí, stejně jako látky, jejichž množství překračuje normu. Ne každá změna složení moči však svědčí o poškození ledvin. Například bilirubin v moči se objevuje s jaterní žloutenkou, acetonem a cukrem - s cukrovkou.
Nejčastější příznaky onemocnění ledvin jsou:
- Hematurie je výskyt červených krvinek v moči. Za normálních okolností červené krvinky přes filtrační membránu neprocházejí. Při jeho hrubém poškození (akutní glomerulonefritida) erytrocyty pronikají do pouzdra Bowman-Shumlyansky a jsou vylučovány močí, která získává načervenalý odstín. Červené krvinky mohou vstupovat do moči z močovodů (poranění putujícími kameny) nebo z Měchýř(nádor, zánět).
- Proteinurie je vylučování bílkovin močí. Renální proteinurie vzniká buď v důsledku poškození glomerulů, kdy se zvyšuje jejich permeabilita pro bílkoviny, nebo v důsledku porušení reabsorpce bílkovin v tubulech (viz § 307).
- Leukocyturie - přítomnost leukocytů v moči (běžně se jich v močovém sedimentu v zorném poli nenachází více než 1-3). Leukocyturie je charakteristická pro zánětlivé procesy v ledvinách (pyelonefritida) a v močových cestách. Pyurie je výtok zakalené moči s příměsí hnisu a leukocytů.
- Cylindrurie - výskyt různých druhů válců v moči. Například hyalinní odlitky jsou výsledkem koagulace proteinů v lumen tubulů během zánětlivých a dystrofických procesů. Epiteliální a granulární odlitky se skládají z degenerovaných tubulárních epiteliálních buněk.
- U nefrolitiázy se objevuje srážení solí ve formě urátů, oxalátů a fosfátů.
§ 311. Onemocnění ledvinovými kameny
Onemocnění ledvinových kamenů je důsledkem zhoršeného vylučování solí ledvinami. Příčina tohoto onemocnění není dobře pochopena. K tvorbě kamenů v ledvinách přispívá řada faktorů: porucha metabolismu minerálů, infekce močových cest, stagnace moči, poškození ledvin, nedostatek vitamínů A a D v potravě, dědičná metabolická vada (oxalóza).
Kameny jsou složeny z fosfátů (vápenaté soli kyseliny fosforečné), oxalátů (vápenaté soli kyseliny šťavelové), urátů (soli kyseliny močové) a mohou mít smíšené složení. Existují cystinové kameny s dědičným onemocněním (cystinurie), sulfanilamidové kameny se zvýšenou koncentrací sulfanilamidových léků v moči, xantinové kameny.
Podle teorie krystalizace se kameny tvoří v důsledku přesycení moči krystaloidy a jejich vysrážením.
Podle teorie matrice jsou soli navrstveny kolem skeletu sestávajícího z proteinu a sacharidů (nerozpustný mukopolysacharidový komplex). Na jeho tvorbě se podílejí plazmatické proteiny, které intenzivně pronikají do pouzdra se zvýšenou glomerulární permeabilitou, a také uromukoid vylučovaný epitelem tubulů v důsledku jejich dráždění. Organická matrice se primárně tvoří v tubulech minimálně u 95 % kamenů. K růstu kamene dochází ukládáním střídajících se soustředných vrstev mukopolysacharidů a krystaloidů na něm.
Ledvinové kameny a sedimenty v moči mají různý tvar a různou velikost. Nacházejí se ve formě malých zrnek písku nebo velkých útvarů, které vyplňují dutinu pánve.
Pokračování: Kapitola 3. Selhání ledvin
bono-esse.ru
Struktura nefronu
Moč je koncentrát látek, jejichž odstranění z těla je nutné pro udržení stálosti vnitřního prostředí. Jedná se o jakési „plýtvání“ životem, včetně toxických, jehož další přeměna je nemožná a hromadění je škodlivé. Funkci odstraňování těchto látek plní močový systém, jehož hlavní součástí jsou ledviny – biologické filtry. Krev jimi prochází a zbavuje se přebytečné tekutiny a toxinů.
Na Obr. 1 schematicky znázorňuje strukturu nefronu. A - renální tělísko: 1 - aferentní tepna; 2- eferentní tepna; 3 - epiteliální listy pouzdra (vnější a vnitřní); 4 - začátek tubulu nefronu; 5 - cévní glomerulus. B - samotný nefron: 1 - glomerulární pouzdro; 2 - tubulus nefronu; 3 - sběrné potrubí. Krevní cévy nefronu: a - aferentní tepna; b - eferentní tepna; c - tubulární kapiláry; d - žíla nefronu.
Při různých patologických procesech dochází k reverzibilnímu nebo nevratnému poškození nefronů, v důsledku čehož některé z nich mohou přestat plnit své funkce. V důsledku toho dochází ke změně produkce moči (zadržování toxinů a vody, ztráta užitečné látky přes ledviny a další syndromy).
Pojem glomerulární filtrace
Proces tvorby moči se skládá z několika fází. V každé z fází může dojít k poruše vedoucí k porušení funkce celého orgánu. První krok při tvorbě moči se nazývá glomerulární filtrace.
Provádí se ledvinovým tělískem. Skládá se ze sítě malých tepen vytvořených ve formě glomerulu obklopeného dvouvrstvým pouzdrem. Vnitřní list pouzdra těsně přiléhá ke stěnám tepen a tvoří ledvinovou membránu (glomerulární filtr, z latiny glomerulus - glomerulus).
Skládá se z následujících prvků:
- endoteliální buňky (vnitřní "výstelka" tepen);
- epiteliální buňky-kapsle tvořící jeho vnitřní vrstvu;
- vrstva pojivové tkáně (bazální membrána).
Právě přes ledvinnou membránu dochází k vylučování vody a různých látek a na jejím stavu záleží, jak plně ledviny plní svou funkci.
Velké (proteinové) molekuly a buněčné elementy krve neprocházejí ledvinovou membránou. Při některých onemocněních jím mohou pro jeho zvýšenou propustnost ještě projít a dostat se do moči.
Roztok iontů a malých molekul ve filtrované tekutině se nazývá primární moč. Obsah látek v jeho složení je velmi nízký. Je podobný plazmě, ze které byl protein odstraněn. Ledviny za jeden den přefiltrují od 150 do 190 litrů primární moči. V procesu další transformace, kterou primární moč prochází v tubulech nefronu, se její konečný objem zmenší asi 100krát, na 1,5 litru (sekundární moč).
Tubulární sekrece a reabsorpce - procesy tvorby sekundární moči
Vzhledem k tomu, že při pasivní tubulární filtraci se do primární moči dostává velké množství vody a pro tělo nezbytných látek, bylo by biologicky nepraktické ji z těla odstraňovat v nezměněné podobě. Některé toxické látky se navíc tvoří v dost velkém množství a jejich vylučování by mělo být intenzivnější. Proto primární moč, procházející systémem tubulů, prochází transformací prostřednictvím sekrece a reabsorpce.
Na Obr. 2 ukazuje tubulární reabsorpci a vzory sekrece.
Tubulární reabsorpce (1). Jedná se o proces, v jehož důsledku se voda, stejně jako potřebné látky, působením enzymatických systémů, mechanismů iontové výměny a endocytózy „odebírá“ z primární moči a vrací se zpět do krevního řečiště. To je možné díky skutečnosti, že tubuly nefronu jsou hustě propleteny kapilárami.
Tubulární sekrece (2) je reverzní proces reabsorpce. Jedná se o odstraňování různých látek pomocí speciálních mechanismů. Epiteliální buňky aktivně, na rozdíl od osmotického gradientu, „stahují“ určité látky z cévního řečiště a vylučují je do lumen tubulů.
V důsledku těchto procesů v moči dochází ke zvýšení koncentrace škodlivých látek, jejichž vylučování je nutné, ve srovnání s jejich koncentrací v plazmě (například amoniak, metabolity léčiv). Zabraňuje také ztrátě vody a živin (například glukózy).
Některé látky jsou lhostejné k procesům sekrece a reabsorpce, jejich obsah v moči je úměrný obsahu v krvi (příkladem je inzulín). Korelace koncentrace takové látky v moči a krvi nám umožňuje usoudit, jak dobře nebo špatně probíhá glomerulární filtrace.
Glomerulární filtrace: klinický význam, princip stanovení
Glomerulární filtrace (GFR) je ukazatelem, který je hlavním kvantitativním odrazem procesu tvorby primární moči. Abychom pochopili, jaké změny odrážejí výkyvy tohoto ukazatele, je důležité vědět, na čem GFR závisí.
Je ovlivněn následujícími faktory:
- Objem krve procházející cévami ledvin za určité časové období.
- Filtrační tlak je rozdíl mezi tlakem v tepnách ledviny a tlakem filtrované primární moči v pouzdru a tubulech nefronu.
- Filtrační plocha - celková plocha kapilár, které se podílejí na filtraci.
- Počet funkčních nefronů.
První 3 faktory jsou relativně variabilní a jsou regulovány lokálními a obecnými neurohumorálními mechanismy. Poslední faktor - počet fungujících nefronů - je zcela konstantní a právě on nejsilněji ovlivňuje změnu (pokles) rychlosti glomerulární filtrace. Proto v klinická praxe GFR se nejčastěji studuje k určení stadia chronického selhání ledvin (vyvíjí se právě kvůli ztrátě nefronů v důsledku různých patologických procesů).
OBEZITA A METABOLISMUS 1"2009
Koncentrační funkce ledvin u primární hyperparatyreózy
Primární hyperparatyreóza (pHPT) je onemocnění s mnoha klinickými projevy: osteoporóza a zvýšené riziko zlomenin, tvorba kamenů v ledvinách, zhoršení funkce ledvin, peptický vřed žaludku a dvanáctníku, svalová slabost, únava, to vše je přímý důsledek zvýšení hladiny parathormonu (PTH) a hyperkalcémie. Jedním ze zajímavých aspektů tohoto onemocnění je polyurie a polydipsie. V současnosti je patogeneze těchto jevů málo prozkoumána a i dostupné klinické popisy jejich závažnosti jsou pouze roztroušenými údaji nalezenými v některých publikacích. Účelem tohoto přehledu je shrnout dostupná klinická data a objasnit mechanismy rozvoje symptomů.
Polyurie často doprovází pHPT, ale těžká polyurie a dehydratace jsou vzácné, obvykle pouze u těžkého onemocnění, doprovázeného vysokou hladinou PTH a vápníku. Navíc koncentrační funkce ledvin je téměř vždy obnovena po radikální operaci. To je důvod, proč většina lékařů léčí polyurii pomocí pGPT poněkud odmítavě. Vzhledem k tomu, že pHPT je nyní diagnostikováno stále častěji, má však mnoho pacientů mírnou formu onemocnění, ne všichni pacienti vyžadují chirurgickou léčbu a možná i konzervativní řízení a sledování, měla by se zvýšit pozornost na zhoršenou funkci koncentrace ledvin. Ve studii o prediktorech úmrtí u pGPT byla porucha koncentrační funkce ledvin jedním z důležitých faktorů spolu s vyšším věkem, mužským pohlavím, sníženou glomerulární filtrací, přítomností kardiovaskulárního onemocnění, diabetes mellitus a velkým objemem resekovaných nádorů. Zvýšení 24hodinové osmolality moči měřené zátěží pitresinem, minirinem nebo při testu se suchou stravou o 1 mosmol/l snížilo riziko úmrtí o 0,11 %. Riziko úmrtí u pacientů, kteří podstoupili pHPT, je přitom v každém případě vyšší než u populace, a to i při zachování koncentrační funkce ledvin.
Podle studie G. Hedbacka et al.
A.V. Belyaeva, N.G. Mokrysheva, L.Ya. Rožinská
Federální státní instituce Endokrinologické výzkumné centrum, Moskva (ředitel - akademik Ruské akademie věd a Ruské akademie lékařských věd, prof. I.I. Dedov)
centrální funkce ledvin u pGPT, osmolalita moči na pozadí stimulačních testů u pacientů s pGPT byla 636+160 mosmol/l. Po adenomektomii do týdne došlo u 59 z 63 pacientů k významnému zvýšení osmolality moči o 143+114 mosmol/l, v průměru o 28 %. U zbývajících pacientů se koncentrační funkce ledvin nezměnila nebo se mírně zhoršila. Analýza dlouhodobého efektu (3-5 let) adenomektomie ve stejné studii ukázala, že během této doby zůstala osmolalita moči ve vzestupném trendu, zlepšení oproti předoperačním ukazatelům nastalo u 33 z 35 pacientů do 202+ 132 mosmol/l, pak je průměr 37 %. Hlavní nevýhodou studie je její retrospektivní charakter, chybějící randomizace při tvorbě vzorku a absence kontrolní skupiny.
Hlavním úspěchem jejich práce byl podle vědců důkaz, že po chirurgické léčbě se obnovuje koncentrační funkce ledvin. Tento výsledek potvrzuje data dvou podobných studií provedených v 60. letech minulého století s přesnějšími a statisticky zpracovanými údaji. Analýza také poskytla důkaz, že stupeň zvýšení osmolality moči závisí na hladině vápníku před operací a v menší míře na věku pacienta, přítomnosti současného poškození kardiovaskulárního systému a závažnosti denního hyperkalciurie. Lze předpokládat, že počáteční závažnost onemocnění přímo ovlivňuje koncentrační funkci ledvin. U pacientů s lehkou formou onemocnění, přestože nebyli do studie zařazeni, pouze 14 osob, však došlo také k úpravě osmolality moči po chirurgické léčbě a výchozí ukazatele se obecně nelišily od hlavní skupiny. Mezi pacienty s nezměněnou nebo oproti očekávání sníženou osmolalitou měli téměř všichni urolitiázu a infekci močových cest, zatímco u většiny pacientů s podobným poškozením ledvin došlo k úplné úpravě osmolality moči. Pokusy spojit stupeň obnovy osmolality moči s hladinou kreatininu v krvi, rychlostí glomerulární filtrace, poškozením kostí, neuromuskulárními příznaky selhaly. Sedm
pacientů sledovaných v průměru pět let bez chirurgické léčby, došlo k poklesu osmolality moči o 15±8 %, autoři však u těchto pacientů neindikovali dynamiku základního onemocnění a stav ledvin. V jiné studii od stejných autorů byla nalezena slabá signifikantní korelace mezi osmolalitou moči a objemem odstraněného nádoru, což nepřímo naznačuje, že porušení koncentrační funkce ledvin je odrazem závažnosti onemocnění. Zajímavé je, že zvýšené riziko úmrtí při zhoršení koncentrační funkce ledvin neodpovídalo malému poklesu rizika úmrtí u pacientů s urolitiázou, na základě čehož autoři usuzují, že mechanismus poškození ledvin vedoucí ke snížení koncentrační funkce u pGPT a tvorba kamenů se může lišit.
Reverzibilita narušené koncentrační funkce ledvin byla prokázána i v jiné práci. Autoři zaznamenali u pacienta s hyperosmolaritou plazmy pGPT, polyurií, isostenurií, stejně jako ztrátu K + ledvinami a zvýšení sérových hladin vazopresinu. Po adenomektomii se všechny ukazatele, kromě hyperkaliurie, vrátily k normálu. V dalším klinickém popisu dvou případů hyperkalcemické nefropatie spojené s pGPT pacienti podstoupili biopsii ledvin. Histologické vyšetření odhalilo známky chronických zánětlivých změn v intersticiu ledviny a fokální atrofii a nekrózu tubulů a také fokální sklerózu glomerulů. Je třeba poznamenat, že popis klinického obrazu odpovídá v obou případech těžké formě pGPT.
Ve studii Janssona S. (v roce 2004), která vyšetřila 20 pacientů, se naopak ukázalo, že ani po injekci bisfosfonátů, ani po chirurgické léčbě pGPT nedošlo ke změnám osmolality moči. Je třeba poznamenat, že v této studii byla osmolalita moči stanovena bez předchozí stimulace a u těch pacientů, kteří ji před léčbou potřebovali, byla provedena rehydratace. Obdobný výsledek přinesla studie van "t Hoff W. a Bicknell E.J., během které bylo vyšetřeno 29 pacientů, kteří byli konzervativně sledováni v průměru 2,7 roku, a 17 operovaných pacientů. Celkově byla hladina osmolality měřeno na počátku a při pozorování moči ve vzorku se suchou stravou a u nikoho nebylo zjištěno porušení koncentrační funkce ledvin. Autoři usuzují, že s největší pravděpodobností je charakteristické porušení koncentrační funkce ledvin pouze u velmi těžkých forem onemocnění, které jsou v současnosti vzácné, ale nevylučují možnost, že ve studii Marxe S. J. et al. byla osmolalita moči hodnocena ve vzorku se suchou stravou u 40 pacientů s pGPT. operovaní pacienti nevykázali po měsíci žádné zlepšení.
Zůstává tedy ne zcela jasné, co rozhoduje o míře a přítomnosti počátečního postižení a následné obnově koncentrační funkce ledvin, jaké jsou mechanismy progrese tubulopatie.
Nyní je známo, že symptom polyurie je spojen spíše s hyperkalciurií než s hyperkalcémií. Z klinických příkladů je známo, že polyurie může doprovázet hyperkalciurii různého původu. Naopak u dědičné hypokalciurické hyperkalcémie spojené s mutací genu pro receptor citlivý na vápník (CASR) není polyurie pozorována. Je také známo, že u zdravých lidí závisí koncentrace vápníku v moči nejen na jeho denním příjmu, ale také na pitném režimu. Například kalciurie je značně zvýšena omezením vody, protože reabsorpce vody ve sběrných kanálcích nefronu se zvyšuje stimulací vasopresinu. Předpokládá se, že to je důvod, proč je frekvence urolitiázy, do značné míry spojená se zvýšením kalciurie, vyšší v horkých suchých oblastech.
Porušení koncentrační funkce ledvin nastává v důsledku přímého toxického účinku hyperkalcémie a hyperkalciurie na procesy tubulární reabsorpce. Výsledná polyurie může dosáhnout 3-5 litrů denně a vést k dehydrataci, ztrátě sodíku, draslíku, hořčíku a fosfátů.
Pro lepší pochopení procesů konjugace vápníku a transportu vody v nefronu je nutné hlouběji porozumět procesům reabsorpce Ca2+. U zdravého člověka se vyloučí méně než 2 % vápníku filtrovaného v ledvinových glomerulech. Je zřejmé, že reabsorpce vápníku je velmi intenzivní. Reabsorpce Ca2+ probíhá téměř ve všech částech nefronu a je regulována SLBP, PTH, kalcitoninem a kalcitriolem. Stojí za zmínku, že regulace je velmi jemně vyladěna, protože i malý rozdíl mezi vápníkem vstupujícím do těla a vylučovaným ledvinami může vést k výrazné nerovnováze vápníku a vápníku, pokud přetrvává po mnoho dní.
Lokální regulaci vylučování Ca2+ a konjugaci vylučování Ca2+ s reabsorpcí Na+ a vody zajišťuje SLBP. SLBP je exprimován v mnoha částech nefronu. Jsou to apikální membrána proximálního stočeného tubulu a bazolaterální membrána kortikálního a medulárního distálního rektálního tubulu Henleovy kličky a distálního stočeného tubulu, dále některé buňky korových sběrných kanálků a samozřejmě apikální membrána sběrného kanálku vnitřní zóny dřeně. Existují důkazy, že SLBE ovlivňuje fungování přenašečů Ca2+/Mg2+ ve všech regionech.
Přibližně 70 % přefiltrovaného Ca je reabsorbováno v proximálních stočených a proximálních tubulech rekta. Tento proces je izoosmotický, tj. paralelně se resorbuje Ca2+, Na+ a voda. Hnací síla reabsorpce je na začátku (tj.
OBEZITA A METABOLISMUS 1"2009
OBEZITA A METABOLISMUS 1"2009
v proximálnější části) koncentrace, poté elektrochemický gradient. Přibližně 1/5 Ca se reabsorbuje transepiteliálně. Obecně platí, že proximální nefron, pokud je známo, není zapojen do vztahu mezi výměnou Ca2+ a vody.
Smyčka Henle. Tenké sestupné a vzestupné segmenty Henleovy smyčky jsou prakticky nepropustné pro Ca2+ a extrémně propustné pro Ca+ a vodu. Ca2+ je však propustný pro distální rektální tubulus Henleovy kličky, který obsahuje řadu vápníkových kanálů a kotransportér CaK2C1. V tomto posledním místě se asi 20 % přefiltrovaného vápníku reabsorbuje.
Většina experimentálních dat ukazuje, že reabsorpce vápníku je pasivní při působení pozitivního elektrochemického gradientu v lumen tubulu. Hlavním transportním mechanismem je paraepiteliální dráha. Je známo, že mezi těsné kontakty buněk této oblasti (tedy mezibuněčné zóny) patří protein paracellin-1 (parasell-1, PCK-1), který pravděpodobně vykonává hlavní kontrolu nad pasivní reabsorpcí Ca ( a zároveň Mg2+). Tenhle typ transport závisí na transportu Ka+ podílejícího se na tvorbě transepiteliálního elektrochemického gradientu. Narušení transportu Ca+, například pumpa Ca+, která odstraňuje Ca+ z buňky z bazolaterální strany, přímo ovlivňuje reabsorpci Ca2+. Paracelulární transport Ca2+ však neovlivňuje reabsorpci Ca+. To je potvrzeno zjištěným dědičným onemocněním spojeným s homozygotní mutací PCNK-1 a vedoucím ke zvýšené renální ztrátě Ca2+ a Mg2+, avšak s intaktní reabsorpcí Ca+ a C1- v tomto segmentu (primární hypomagnezémie).
Existují však důkazy o aktivním transportu Ca2+ v distálním přímém tubulu kortikálních (krátkých) Henleových kliček. Aktivní transport je transepiteliální. Ca2+ ze strany apikální membrány vstupuje do buňky působením silného koncentračního gradientu a z bazolaterální strany je z buňky odstraňován pomocí Ca+/Ca2+ výměníku. Předpokládá se, že aktivita tohoto konkrétního výměníku je regulována PTH, ačkoliv mechanismy regulace nejsou zcela jasné.
V důsledku transportu vápníku a v závislosti na koncentraci Ca2+ v séru vzniká určitá koncentrace Ca2+ v intersticiálním prostoru bazolaterální strany tubulu. Je známo, že SLBP jsou lokalizovány na bazolaterální membráně epitelu distálního rektálního tubulu. Interakce s ionty Ca2+ má inhibiční účinek na kotransportér NaK2C1 apikální membrány, kanály K+ NROM apikální membrány, které zajišťují recirkulaci K+, a na výměník 3Ka+/2K+ bazolaterální membrány. S největší pravděpodobností je účinek aktivace SLBP způsoben snížením produkce cAMP a zvýšením jeho degradace, což je důvodem inhibice K+ kanálů. Existují důkazy, že stimulace SLBE také vede ke zvýšení produkce jiných molekul (například 20-HETE), které navíc inaktivují
K+ kanály. V důsledku těchto procesů klesá recirkulace K+ a v souladu s tím klesá i transport Na+, C1- a po nich Ca2+, Mg2+. Je známo, že aktivační mutace v genu SLAD jsou příčinou Bartterova syndromu typu V, při kterém spolu s hypokalemickou metabolickou alkalózou dochází ke ztrátě Ka ledvinami a ke kompenzační hyperreninemii a hyperaldesteronismu. Pravděpodobně je úlohou SLAD v tomto segmentu za fyziologických podmínek reakce na relativní hyperkalcémii. Menší reabsorpce sodíku snižuje transepiteliální elektrochemický gradient (pozitivní v lumen, negativní na bazolaterální straně), který je hlavní hnací silou reabsorpce Ca2+ v tomto segmentu. Reabsorpce vápníku je tedy snížena. Popsaný mechanismus je poněkud podobný účinku kličkových diuretik, protože snížení reabsorpce Ca + v distálním rektálním tubulu snižuje osmotický gradient, který je základem fungování protiproudého systému. Závažnost inhibičního účinku vyvolaného SLBP na výše uvedené vektory však není známa.
Distální stočený tubulus a spojovací trubice (spojovací tubulus). V distální části nefronu, sestávající z distálního stočeného tubulu a spojovací trubice, se reabsorbuje asi 15 % přefiltrovaného Ca2+. V těchto segmentech dochází k reabsorpci prostřednictvím aktivního transcelulárního transportu proti existujícímu elektrochemickému gradientu. Kontroverzní zůstává přesné umístění zón, ve kterých se provoz odehrává. Je známo, že většina kalciových kanálů a transportérů je soustředěna v distální třetině distálního stočeného tubulu a ve spojovací trubici. Přesné mechanismy regulace těchto transportérů nejsou známy. Existují důkazy, že transportní aktivita Ca2+ je řízena PTH, kalcitoninem a kalcitriolem. Například PTH stimuluje výměník Ca+/Ca2+ umístěný na bazolaterální membráně a také v distálním tubulu rekta Henleovy kličky, ale pro stimulaci reabsorpce Ca2+ PTH bylo navrženo mnoho dalších mechanismů. Neexistuje také žádný důkaz, že koncentrace Ca2+ má vliv na transport vody v těchto segmentech.
sběrné zkumavky. Sběrné kanály jsou zodpovědné za reabsorpci asi 3 % vápníku. Transport Ca2+, stejně jako v distálních tubulech, probíhá proti elektrochemickému gradientu a je aktivní. Je známo, že přenašeče Ca2+ jsou umístěny na hlavních buňkách (v této části se také objevují interkalární, zodpovědné za acidobazickou rovnováhu). Přes vápníkové kanály vstupuje Ca2+ z lumen tubulu do buňky tubulárního epitelu, poté se pomocí řady intracelulárních transportních proteinů Ca2+ přesune na bazolaterální povrch, poté je odstraněn do intersticiálního prostoru pomocí kalciové pumpy. Při studiu transportu Ca2+ ve sběrných kanálcích vnitřní zóny dřeně u potkanů byla zavedena mikroperfuzní metoda
ale tato transportní aktivita závisí na transepiteliálním koncentračním gradientu Ca2+. Podle jiných studií se transportní aktivita po tyreoparatyreoidektomii nezměnila, to znamená, že nezávisela na hladině PTH a kalcitoninu a v epitelu sběrných kanálků nebyla detekována mRNA receptoru PTH a peptidu příbuzného PTH. .
Ve studii Sandse J. et al. provedených na krysách se ukázalo, že sběrné kanálky vnitřní zóny dřeně obsahují mechanismus, který oslabuje působení vasopresinu se zvýšením intraluminální koncentrace Ca2+. Zvýšení intraluminální koncentrace Ca2+ z 1 na 5 mmol/l za přítomnosti vasopresinu rychle (během 10 min) a významně snížilo propustnost stěny tubulu pro vodu o 30 %. Tento účinek byl opakován s použitím CASR agonisty neomycinu a byl částečně eliminován po promytí roztoku, který prokrvoval tubulus. Použití specifických protilátek ve stejné studii ukázalo, že u lidí a potkanů se CASR nacházejí hlavně v distální třetině sběrných kanálků vnitřní zóny dřeně na apikální membráně, stejně jako vodní kanály, aquaporin-2. A že transdukce signálu je zjevně způsobena proteinkinázou C, která je také přítomna v těchto buňkách a je známým mediátorem signálu CASR.
V jiné studii na potkanech se ukázalo, že maximální renální koncentrační kapacita při hyperkalcémii je snížena asi o 20 % ve srovnání s kontrolami zeslabením účinku vasopresinu, a to i po korekci na zvýšenou produkci renálních prostaglandinů a snížení medulárního osmotického gradientu.
Kromě výše popsaných mechanismů bylo u potkanů s hyperkalcémií vyvolanou PTH pozorováno zvýšení exprese genu CASR a snížení exprese genů mnoha nosičů Na+ z proximálního stočeného tubulu do sběrných kanálků, což byla doprovázena poklesem koncentrační schopnosti ledvin, hypernatriurií, hyperkalciurií, hyperfosfaturií. Zjištěný účinek závisel na dávce podaného PTH. Při simulaci těžké hyperparatyreózy se projevila suprese exprese nosných genů Na+, což zřejmě sehrálo roli ve vývoji poruchy koncentrační funkce ledvin, natriurie a fosfaturie. Zavedením nižší dávky PTH došlo ke snížení koncentrace v moči, ale nedocházelo k polyurii, natriuréze a poklesu glomerulární filtrace, pokles exprese byl zaznamenán pouze u genů některých přenašečů. V jiné studii bylo prokázáno, že PTH může také snížit poměr glomerulární ultrafiltrace a tedy i rychlost glomerulární filtrace. Ve studii Wang W. et al, kde byla hyperkalcémie vyvolána u potkanů předávkováním vitaminem D, nebyl zjištěn žádný pokles exprese genů transportéru Na+, takže je možné, že tento účinek je způsoben působením PTH a nikoli hyperkalcémie jako taková.
Výše popsaná metoda se používá k propojení homeostázy vápníku a vody na úrovni
ledviny. Jeho fyziologická nutnost spočívá v zabránění vzniku nadměrné koncentrace vápníku v tubulární tekutině a moči. Je-li vyžadováno zvýšené vylučování vápníku ledvinami v důsledku nadměrného příjmu vápníku, vedou malé výkyvy koncentrace vápníku v peritubulární intersticiální tekutině k poklesu transportu NaCl a Ca2+ v distálním přímém tubulu Henleovy kličky zprostředkovaném CASR. Trubicová tekutina se zvýšeným množstvím NaCl, tedy vody a Ca2+ se dostává do sběrných kanálků vnitřní zóny dřeně, kde za podmínek maximální stimulace vazopresinem stále existuje možnost nového zvýšení koncentrace vápníku a tvorby močových kamenů ze šťavelanu vápenatého nebo fosforečnanu. Tomu pomáhá zabránit druhý mechanismus, který snižuje účinnost vasopresinu na reabsorpci vody a zabraňuje opětovnému zvýšení koncentrace vápníku. Kolísání počtu přenašečů Ka+ a CASR také přispívá ke snížení koncentrační kapacity ledvin. Ve všech částech nefronu, zejména těch, které jsou spojeny s aktivní reabsorpcí vody, je tedy koncentrace Ca2+ udržována na úrovni, která zabraňuje tvorbě kamenů.
U stavů patologické hyperkalciurie se vlivem Ca2+ na SLBP na úrovni Henleovy kličky zvětšuje objem intratubulární tekutiny a na úrovni sběrných cest je doplněn o vlastní rozvoj renální formy diabetes insipidus, to znamená, že souvisí s rezistencí ledvin na vazopresin.
Implementace výše uvedených mechanismů za podmínek pGPT vede k dehydrataci organismu jako celku. V mírných případech může být dehydratace kompenzována zvýšeným příjmem tekutin a pacient si ji dokonce nevšimne. V těžkých případech vysoké hyperkalcémie (celkové sérové Ca nad 3,5 mmol/l) se však tělesná dehydratace stává důležitou patofyziologickou složkou těžkého stavu pacienta. Obecná dehydratace může také přispět ke zvracení a hladovění v důsledku ztráty chuti k jídlu a celkové letargie. Při hyperkalcemické krizi může dehydratace dosáhnout takových hodnot, že v důsledku snížení rychlosti glomerulární filtrace se polyurické stadium může změnit na oligourické. Proto léčba vysoké hyperkalcémie, jejímž hlavním cílem je co nejrychlejší snížení hladiny vápníku v krvi, musí začít doplněním objemu cirkulující krve. Teprve po rehydrataci těla a obnovení diurézy, pokud byla snížena, se doporučuje nucená diuréza, protože zvýšení natriurie zvyšuje kalciurii, a specifická hypokalcemická terapie.
Jedním z nejzajímavějších aspektů diskutovaného problému je, že závažnost pozorované poruchy koncentrační funkce ledvin se velmi liší v rámci přibližně stejné hyperkalciurie a hyperkalcémie v rámci pGPT. Jedno z možných vysvětlení tohoto jevu
OBEZITA A METABOLISMUS 1"2009
OBEZITA A METABOLISMUS 1"2009
Změnou by mohl být polymorfismus genu CASR spojený s mírně vyšší nebo mírně nižší citlivostí receptoru na Ca2+. V současné době bylo identifikováno několik polymorfních variant genu CASR, které jsou pozorovány u zdravých lidí au pacientů s urolitiázou. U jednoho z haplotypů bylo prokázáno, že jeho přítomnost v homoheterozygotní poloze koreluje s koncentrací Ca2+ v krevním séru, zatímco druhý haplotyp je spojen se zvýšeným rizikem urolitiázy. Tyto studie jasně prokazují, že metabolismus vápníku jednotlivého organismu závisí na polymorfní variantě genu CASR. Závažnost reakce ledvin na hyperkalcémii/hyperkalciurii tedy může záviset i na ní.
Shrneme-li přehled, můžeme říci, že zhoršení koncentrační funkce ledvin je nepochybným příznakem hyperkalciurie / hyperkalcémie. Může to být také přímý příspěvek k rozvoji
syndrom přispívá ke zvýšeným hladinám PTH. Navzdory skutečnosti, že závažnost poklesu koncentrační funkce ledvin se může velmi lišit, dochází vždy k dehydrataci s výrazným zvýšením hladiny vápníku v krvi a moči. Renální mechanismy tohoto patologického stavu jsou realizovány především prostřednictvím aktivace CASR ionty Ca2+ v různých částech nefronu. Primárně distální rektální tubulus Henleovy kličky a sběrné kanálky. Fyziologickým smyslem je zabránit nadměrnému zvýšení koncentrace Ca2 + v tubulární tekutině a snížit riziko tvorby kamenů. Článek pojednává o mechanismech reverzibilního poškození ledvin při pHPT, které jsou přímým důsledkem charakteristických metabolických změn. Ve vzácných případech přetrvává tubulopatie i po radikální léčbě pHPT. Zbývá objasnit, proč dochází k hlubokým poruchám, stejně jako důvody tak odlišné individuální odpovědi na hyperkalcémii/hyperkalciurii u pHPT.
Literatura
1. Bengele H, Alexander E, Lechene C. Transport vápníku a hořčíku po vnitřním medulárním sběrném kanálku krysy. Am J Physiol Renal Fluid Electrolyte Physiol. - 1980 - 239 (1) - s.24-9.
2. Blanchard A, Jeunemaitre X, Coudol P, a kol. Paracelin-1 je kritický pro reabsorpci hořčíku a vápníku v lidské tlusté vzestupné končetině Henle. Kidney Int - 2001 - 59(6) - pp. 2206-2215.
3. Blaustein M, Lederer W. Výměna sodíku/vápníku: jeho fyziologické důsledky. Physiol Rev. - 1999 - 79(3) - pp. 763-854.
4. Bourdeau J, Burg M. Vliv PTH na transport vápníku přes kortikální tlustou vzestupnou větev Henleovy kličky Am. J. Physiol. - 1980 - 239 (2) - str. 121-6.
5. Edvall CA. Renální funkce u hyperparatyreózy. Acta Chir Scand. -1958 -229 (Suppl) - str. 5-56.
6. Egbuna O, Brown E Hyperkalcemické a hypokalcemické stavy způsobené mutacemi kalciového receptoru. Best Pract Res Clin Rheumatol. - 2008-22(1)-pp. 129-48.
7. Ellis G, Spirtos G, Polsky F. Primární hyperparatyreóza a koexistující nefrogenní diabetes insipidus: rychlá pooperační korekce. South Med.J-1991-84(8)-pp. 1019-22.
8. Fenton R, Knepper M. Mouse Models and the Urinary Concentring Mechanism in the New Millennium. Physiol Rev. - 2007 - 87(4) - str. 1083-1112.
9. Hebert S, Desir G, Giebisch G, Wang W. Molekulární diverzita a regulace renálních draslíkových kanálů. fyziol. Rev. - 2005 - 85(1) -pp. 319-371.
10. Hedback G, Abrahamsson K, Oden A. Zlepšení koncentrační kapacity ledvin po operaci primární hyperparatyreózy. Eur J Clin Invest - 2001 -31 - str. 1048-53.
11. Hedback G, Oden A. Analýza rizikových faktorů úmrtí u primární hyperparatyreózy. Eur J Clin Invest - 1998 - 28 (12) - str. 1011-1018.
12. Hedback G, Oden A. Zvýšené riziko úmrtí na primární hyperparatyreózu, aktualizace. Eur J Clin Invest - 1998 - 28(4) - str. 271-6.
13. Hellstrom J, Ivemark B. Primární hyperparatyreóza, klinický a strukturální nález u 138 případů. Acta Chir Scand. - 1962 - 294 (Suppl) - str. 7-60.
14. Hoenderop J, Nilius B, Bindels R. Absorpce vápníku přes epitel. fyziol. Rev. - 2005 - 85(1) - str. 373-422.
15. van "t Hoff W, Bicknell E. Renální tubulární funkce u hyperparatyreózy. Postgraduate Med J. - 1989 - 65 (769) - str. 811-3.
16. Jansson S, Morgan E. Biochemické účinky léčby bisfosfonáty a chirurgie u pacientů s primární hyperparatyreózou. Svět J Surg. -
2004 - 28(12) - str. 1293-97.
17. Kashitani T, Makino H, Nagake Y a kol. Dva případy hyperkalcemické nefropatie spojené s primární hyperparatyreózou. Nippon Jinzo Gakkai Shi. - 1993 -35(10) - str. 1189-94.
18 Kausalya P, Amasheh S, et al. Mutace spojené s onemocněním ovlivňují intracelulární přenos a paracelulární transport Mg2+ klaudinu-16. J Clin Invest. -2006 - 116(4) - str. 878-891.
19. Kukora J, ZeigerM, et al. Americká asociace klinických endokrinologů a Americká asociace endokrinních chirurgů stanovisko k
diagnostika a léčba primární hyperparatyreózy. Endokr. praxe-
2005 - 11 (1) - str. 49-54.
20. Kushner D Vápník a ledviny. Am J Čistá výživa. -1986-4(5)-pp. 561-679.
21. Lee K, Brown D, a kol. Lokalizace mRNA peptidového receptoru parathormonu/parathormonu v ledvině. Am J Physiol Renal Fluid Electrolyte Physiol. - 1996 - 270 - s. 186-91
22. Levi M, Peterson L, Berl T. Mechanismus koncentračního defektu u hyperkalcémie. Role polydyspsie a prostaglandinů. Kidney Int. - 1983 - 23 - s.489-97.
23. Magaldi A, van Baak A, Rocha A. Transport vápníku přes vnitřní medulární sběrný kanál potkana perfundovaný in vitro. Am J Physiol Renal Fluid Electrolyte Physiol. -1989 - 257 - s.738-45.
24. Marx S, Attie M. Maximální schopnost koncentrace moči: familiární hypokalciurická hyperkalcémie versus typický primární hyperparatyreoidismus. J Clin Endocrinol Metab. -1981-52(4)-str. 736-40.
25. Poujeol P, Bidet M, Tauc M. Transport vápníku v distálních buňkách králíka. Kidney Int. -1995-48-pp. 1102-1110.
26 Sands J, Naruse M, et al. Apikální extracelulární vápník/polyvalentní kationtový receptor reguluje vasopresinem vyvolanou propustnost vody ve vnitřním sběrném kanálku dřeňových ledvin potkana. J Clin Invest. - 1997 - 99(6) - str. 1399-1405.
27. Schor N, Ichikawa I, Brenner B. Mechanismy působení různých hormonů a vazoaktivních látek na glomerulární ultrafiltraci u potkanů. Kidney Int. - 1981-20-pp. 442-51.
28 Scillitani A, Guarnieri V, Battista C, et al. Primární hyperperethyroidismus a přítomnost ledvinových kamenů jsou spojeny s různými haplotypy kalciového receptoru J Clin Endocrinol Metab. - 2007 - 92(1) - str. 277-83.
29 Scillitani A, Guarnieri V, De Geronimo S, et al. Vápník ionizovaný krví je spojen s klastrovými polymorfismy v karboxy-terminálním konci receptoru citlivého na vápník. J Clin Endocrinol Metab. - 2004 - 89 - s.5634-38.
30. Vargas-Poussou R, Huang C, a kol. Funkční charakterizace mutace kalciového receptoru u těžké autozomálně dominantní hypokalcémie s Bartter-like syndromem. J Am Soc Nephrol. - 2002 - 13 -pp. 2259-2266.
31. Vezzoli G, Tanini A, Ferrucci L, et al. Vliv genu pro receptor citlivý na vápník na vylučování vápníku močí u pacientů s tvorbou kamenů. J Am Soc Nephrol. -2002-13-pp. 2517-23.
32. Wang W, Kwon T, a kol. Snížená exprese kotransportéru Na-K-2Cl v medulárním TAL u hyperkalcémie vyvolané vitaminem D u potkanů. Am J Physiol Renální Physiol. - 2002 - 282 - s.34-44.
33. Wang W, Lu M, Hebert S. Metabolity cytochromu P-450 zprostředkovávají extracelulární Ca2+-indukovanou inhibici apikálních K+ kanálů v TAL. Am J Physiol Cell Physiol - 1996 - 271-pp. 103-111.
34. Watanabe S, Fukumoto S, a kol. Asociace mezi aktivačními mutacemi kalciového receptoru a Bartterovým syndromem Lancet - 2002 - 360 - str. 692-694.
35. Weidong W, Chunling L, a kol. Snížená exprese renálních transportérů Na+ u potkanů s hyperkalcémií indukovanou PTH. Am J Physiol Renální Physiol. - 2004 -286 - s.534-45.
9588 0
Regulace obsahu vody v těle
Efektivně fungující ledviny udržují normální objem a složení tekutin v těle i při výrazných výkyvech ve stravě, extrarenálních ztrátách vody a rozpuštěných látek. Rovnováhy vody a elektrolytů je dosaženo vylučováním moči o určitém objemu a složení, které je zajištěno ultrafiltrací glomerulární plazmy v kombinaci s následnou tubulární reabsorpcí a sekrecí.Vyloučená konečná moč představuje pouze malou část glomerulárního ultrafiltrátu, změněného během pasáže do nefronu. Glomerulární kapiláry volně procházejí vodou a nízkomolekulárními soluty, přičemž zadržují vytvořené prvky a makromolekuly. Stěna glomerulární kapiláry funguje jako bariéra ve vztahu k makromolekulám, "selektuje" je podle jejich velikosti, tvaru a náboje.
Změna glomerulárního filtrátu při jeho průchodu tubuly se uskutečňuje transportem určitých látek, a to jak aktivních (do lumen tubulů nebo ven z lumen), tak pasivně. Ta je způsobena osmotickou a elektrochemickou rovnováhou a rozdílnou propustností jednotlivých segmentů nefronu.
Systém transportu iontů v renálních epiteliálních buňkách je v zásadě stejný jako funkce jakýchkoli jiných epiteliálních buněk. Renální transportní systém však zajišťuje celkový obsah vody, solí a acidobazickou homeostázu v těle, zatímco lokální procesy probíhající v jiných epiteliálních buňkách regulují pouze určité „fragmenty“ metabolismu voda-sůl, například objem a absorpci tekutin. metabolických produktů..
Aby ledviny účinně regulovaly rovnováhu vody a rozpuštěných látek, musí mít glomerulární filtrát odpovídající objem. Renální průtok krve tvoří 20-30 % srdečního výdeje. Z celkového průtoku plazmy ledvinami prochází 92 % plazmy funkční vylučovací tkání a je definováno jako efektivní průtok plazmy ledvinami (ERF). Rychlost glomerulární filtrace (GFR) je typicky 1/5 GFR, což vede k filtrační frakci 0,2.
Rychlost ultrafiltrace přes glomerulární kapiláry, GFR, je určována stejnými faktory, které určují transmurální pohyb tekutiny v jiných kapilárních sítích těla, jmenovitě transkapilárními gradienty hydraulického a osmotického tlaku a propustností kapilární stěny. Mechanismus autoregulace ledvin umožňuje ledvinám udržovat relativně konstantní průtok krve v přítomnosti měnícího se tlaku, a to jak systémové arteriální, tak renální perfuze.
Zdá se, že tento mechanismus je zprostředkován v nefronech tubulárně-glomerulárními zpětná vazba přes macula densa (oblast na začátku distálního tubulu, sousedící s glomerulem), stejně jako adduktory a eferentní arterioly. Snížení arteriolární rezistence v adduktorových arteriolách při jejím udržení na stabilní úrovni v eferentních arteriolách umožňuje udržení hydrodynamického tlaku v glomerulu, i přes pokles systémového a renálního arteriálního tlaku.
Reabsorpce vody, stejně jako reabsorpce a sekrece rozpuštěných látek během průchodu filtrátu nefronem, normálně slouží k udržení homeostázy tekutin v těle. U zdravého nerostoucího organismu je příjem a vylučování vody a rozpuštěných látek rovnocenný a hydroiontová bilance je tedy nulová. Mechanismy regulace funkce ledvin se mohou měnit pod vlivem různých onemocnění, jak systémových a ledvinových, tak pod vlivem široké škály léků, jako jsou vazopresory a vazodilatancia, nesteroidní antirevmatika, diuretika a antibiotika. Porucha funkce ledvin v pooperačním období se nejčastěji projevuje hypoxií a sníženou renální perfuzí.
Posouzení funkce ledvin
Hodnocení renálních funkcí začíná důkladnou anamnézou a fyzikálním vyšetřením pacienta, po kterém následuje laboratorní vyšetření ke stanovení glomerulární filtrace a renální tubulární funkce. Z anamnézy jsou někdy zřejmé závažné poruchy vylučovací a koncentrační schopnosti ledvin.Vyšetření močového sedimentu může odhalit přímé známky poškození glomerulů nebo renálního parenchymu. Stanovení sérových elektrolytů, vápníku a fosforu je cennou screeningovou metodou charakterizující tubulární poruchy, zatímco koncentrace kreatininu je hlavním indikátorem GFR.
Objem moči. V mnoha různých klinických situacích je často velmi důležité určit, zda pacient vylučuje dostatečný objem moči. Odpověď na otázku, jaká diuréza je adekvátní, je velmi obtížná, protože tento ukazatel závisí na několika faktorech: aktuální vodní bilanci v těle, zatížení tekutinami a extrarenální ztráty, stejně jako obligátní zatížení rozpustnými látkami.
Pacienti se zhoršenou koncentrační schopností ledvin, jako je srpkovitá anémie (u starších dětí a dospělých) a postobstrukční uropatie, vyžadují větší minimální objem moči k vyloučení obligátní zátěže rozpuštěnými látkami než pacienti s normální funkcí koncentrace ledvin.
Stanovení „přiměřenosti“ objemu moči sice ve většině případů působí mnohé obtíže, přesto je vždy důležité si alespoň ujasnit otázku – zda má pacient oligurické selhání ledvin s danou diurézou či nikoliv. Řešení tohoto problému je založeno na znalosti minimálního objemu moči potřebného k odstranění povinné nálože rozpustné látky.
Výpočet je založen na 100 metabolizovaných kaloriích nebo 100 ml náplně H2O, což umožňuje provádět výpočty bez ohledu na tělesnou hmotnost. Fyziologická potřeba vody se pro tento účel vhodně stanoví pomocí metody Hollidaye a Segara (tabulka 5-1). Norma 100 ml / kg / den platí pro děti s hmotností pouze do 10 kg. Dítě o tělesné hmotnosti 15 kg má potřebu vody 83 ml/kg/den a při tělesné hmotnosti 30 kg je to 57 ml/kg/den.
Tabulka 5-1. Fyziologické potřeby vody
Minimální objem moči potřebný k vyloučení povinného zatížení rozpuštěnou látkou se vypočítá pomocí následujících konvencí a předpokladů.
1. Obligátní zátěž rozpuštěnou látkou předpokládaná u pacienta s ischemickým akutním renálním selháním (ARF) bude větší nebo menší než minimální zátěž endogenní rozpustnou látkou hypoteticky 10-15 my/100 metabolizovaných kalorií (nebo na 100 ml spotřebované vody) .. než 40 mosm na 100 kalorií přijatých při běžné stravě.4 Přibližně 30 mých obligátních solutů na 100 ml kalorií bude u nás přijato jako povinná solutová zátěž u dětí ve věku 2 měsíců a starších.
2. Koncentrační kapacita ledvin se rychle zvyšuje během 1. roku života a ve druhém roce života dosahuje úrovně charakteristické pro starší děti (1200-1400 mosm / kg) ve druhém roce života. Maximální koncentrační kapacita ledvin donošeného dítěte ve věku od 1 týdne do 2 měsíců se pohybuje od 600 do 1100 mosm/kg a ve věku 10-12 měsíců je v průměru o něco vyšší než 1000 mosm/kg. Tabulka 5-2 uvádí minimální objemy moči, které umožňují pacientovi vyrovnat se s obligátní zátěží rozpuštěnou látkou, a poskytují tak vhodnou fyziologickou odpověď na renální hypoperfuzi.
Tabulka 5-2. Minimální objemy moči potřebné k vyloučení povinného zatížení rozpuštěnou látkou 
Při ischemickém akutním selhání ledvin je diuréza obvykle významně snížena. Objem moči se vypočítá podle následujícího vzorce:
Objem moči = Zatížení rozpuštěnou látkou (moje) Koncentrace rozpuštěné látky (moje)
Ischemické akutní selhání ledvin se zpravidla nevyskytuje u dítěte do 2 měsíců s objemem moči >1,25 ml/hod/100 ml přijaté tekutiny, stejně jako u staršího pacienta s diurézou >1,0 ml/ hodina/ 100 ml. Děti s objemy moči pod těmito hodnotami vyžadují další vyšetření a vyšetření na oligurické selhání ledvin.
Neoligurické selhání ledvin je závažný stav, který se vyskytuje téměř stejně často jako oligurické selhání ledvin a je diagnostikováno, když existují další jasné známky snížené GFR při normální diuréze, nejčastěji zvýšená hladina sérového kreatininu nebo snížená clearance kreatininu.
Glomerulární filtrační rychlost. Rychlost glomerulární filtrace je v mnoha ohledech nejdůležitějším měřítkem funkce ledvin, protože odráží množství plazmatického ultrafiltrátu vstupujícího do tubulů. Pokles GFR je hlavní funkční poruchou jak u akutního, tak u chronického selhání ledvin. Stanovení GFR je nezbytné nejen pro posouzení funkce ledvin jako takové, ale i pro správná volba antibiotika a další léky.
Metoda inulinové clearance pro měření GFR má řadu nevýhod. Koncentrace močoviny v séru se nepoužívá jako indikátor GFR kvůli velkým výkyvům s příjmem dusíku v potravě.
Pro hodnocení GFR v praxi se nejvíce využívá měření koncentrace sérového kreatininu a jeho clearance. Při použití této metody je třeba vzít v úvahu řadu okolností. Například konzumace potravin s vysokým obsahem bílkovin (maso, drůbež, ryby) zvyšuje sérový kreatinin o 22 mmol/l po 2 hodinách a zvyšuje rychlost vylučování kreatininu o 75 % během následujících 3 až 4 hodin. Proto by při měření koncentrace kreatininu v séru a jeho clearance měly být tyto produkty vyloučeny z potravy. Kromě toho se hladina kreatininu v séru může zvýšit v důsledku užívání některých léků, jako je trimetonrim, který „soupeří“ s kreatininem v procesu tubulární sekrece.
Trimethoprim, aniž by ovlivnil GFR, mění koncentraci kreatininu v séru, což může způsobit potíže při hodnocení pacienta s poruchou noční funkce, protože frakce kreatininu v moči v důsledku tubulární sekrece stoupá, zatímco GFR klesá.
Koncentrace kreatininu v séru novorozence během prvního týdne života odpovídá hladině matky a od 2. týdne do 2 let je v průměru 35 + 3,5 mmol/l. Během tohoto věkového období je koncentrace kreatininu v séru relativně konstantní, protože během procesu růstu nedochází k velkým změnám v procentu svalové hmoty v těle.
Se zvýšením GFR jde ruku v ruce zvýšení endogenní produkce kreatininu, která koreluje se svalovou hmotou. Během prvních dvou let života se GFR, vyjádřená v ml/min na jednotku tělesného povrchu, zvyšuje z 35–45 ml/min/1,73 m2 na úroveň u dospělých 80–170 ml/min/1,73 m2. Normální koncentrace kreatininu v séru se zvyšují po 2 letech věku s pubertou, zatímco GFR zůstává na jednotku tělesného povrchu poměrně konstantní.
To je způsobeno rozvojem svalové hmoty v procesu růstu dítěte, a tedy zvýšením produkce kreatininu, které je rychlejší než zvýšení GFR na jednotku tělesné hmotnosti. Tabulka 5-3 uvádí průměrné hladiny kreatininu v plazmě nebo v séru v různém věku.
Tabulka 5-3. Hladiny kreatininu v plazmě v různém věku 
Frakční vylučování (FE) sodíku a hydrogenuhličitanu. Frakční vylučování je ukazatelem funkce ledvin, který je důležitý při posuzování některých klinických stavů a představuje množství (frakci) látky filtrované v ledvinách, která se vylučuje močí. Frakční vylučování se měří pomocí clearance kreatininu, která určuje GFR, a koncentrace této látky v séru a moči.
Odfiltrované množství se vypočítá vynásobením sérové koncentrace GFR a vyloučené množství se vypočte vynásobením koncentrace látky v moči objemem moči. Proto se frakční vylučování sodíku vypočítá takto:

kde UNa a UCr jsou koncentrace sodíku a kreatininu v moči, respektive RChl a RGg jsou jejich koncentrace v plazmě nebo séru. Vzhledem k tomu, že objemy moči v čitateli a jmenovateli jsou sníženy a „opouští“ vzorec, lze frakční vylučování vypočítat na základě stanovení pouze koncentrace sodíku a kreatininu ve vzorcích krve a moči odebraných přibližně ve stejnou dobu.
Frakční vylučování sodíku. FENa je obvykle méně než 1 %, ale může se zvýšit se zvýšeným příjmem soli, adaptací na chronické selhání ledvin a podáváním diuretik. S poklesem renálního perfuzního tlaku, který je obvykle charakteristický pro hypovolémii a srdeční selhání, ledviny, adaptující se na vzniklé poruchy, výrazně zvyšují tubulární reabsorpci sodíku a vody, v důsledku čehož je moč vylučována koncentrovaně a v malém množství. množství. Tedy SEN< 1 % является физиологической реакцией на уменьшение реналыюй перфузии. При ишемической ОПН ФЭNa обычно > 2%.
Při použití FENa pro diferenciální diagnostiku mezi prerenální azotemií a akutním renálním selháním mohou být získaná data nespolehlivá, pokud pacient dostal diuretika krátce před studií. Prerenální azotémie se může vyvinout u pacientů s již existujícím chronickým onemocněním ledvin s FENa > 1 % jako adaptace na chronické onemocnění ledvin.
Pokud mají tito pacienti hypovolismii, pak právě s ní může být zvýšená hladina močoviny a sérového kreatininu a vysoká FENa, FENa, stejně jako další „diagnostické ukazatele“ používané v diferenciální diagnostice prerenální azotemie s ischemickým akutním selháním ledvin. částečně asociovaný, není patognomický ani pro jeden, ani pro druhý z těchto typů patologie. Nicméně FENa dává velmi důležitá informace pokud jsou analyzovány jako součást obecného klinického hodnocení.
Frakční vylučování bikarbonátu. Renální tubulární acidóza (RTA) je termín, který definuje skupinu poruch, u kterých metabolická acidóza vzniká v důsledku poruchy reabsorpce filtrovaného HCO3 nebo vylučování vodíkových iontů, při absenci významného poklesu GFR. Obvykle by PTA měla být zahrnuta do seznamu patologií diferencovaných u pacientů s metabolickou acidózou, normální sérovou aniontovou mezerou (hyperchloremická metabolická acidóza) a pH moči nad 6,0. U pacientů s proximální RTA, která se vyvine v důsledku zpomalení tubulární reabsorpce HC07, může být pH moči nižší než 6,0. když je plazmatická koncentrace HCO3 pod prahem renální reabsorpce.
S PTA typu IV (volitelně distální forma) metabolická acidóza s normálním sérovým aniontovým gapem je spojena s hyperkalémií a kyselou močí (viz vysvětlení níže). Když se u proximálního typu PTA normalizuje plazmatická koncentrace HCO3 adekvátním podáním hydrogenuhličitanu sodného, v kovovém nefronu se zvyšuje obsah HCO3 a moč se stává vysoce alkalickou.Při běžné stravě se veškerý filtrovaný HCO3 reabsorbuje a HCO3 PE je 0. pH moči 6,2 ppm je nižší, což naznačuje, že HCO3 v moči je zanedbatelný.
PC02 moči nebo rozdíl mezi pCO2 moči a krve (U-B pCO2). Distální PTA ve své klasické formě je charakterizována hyperchloremickou metabolickou acidózou, pH moči nad 6,0, nezměněná nebo snížená koncentrace HCO2 v séru a FE HCO3<5% при нормальном уровне сывороточного HCO3. Причиной классического листального ПТА является неспособность клеток нефрона секретировать Н в просвет канальцев, где при наличии НСО3 образуется угольная кислота (Н2С03).
Opožděná dehydratace H2CO3 v medulárních sběrných kanálcích, ledvinné pánvičce a močovém měchýři vede ke zvýšení pCO2, což je charakteristické pro normální distální sekreci H+, když je v moči vysoká HCO2 (tj. pCO2 v moči > 80 mmHg nebo /U—B pCO2/ > 30 mm Hg). PCO2 v moči se stanoví po podání jednorázové dávky hydrogenuhličitanu sodného (2–3 mmol/kg) nebo diakarbu (17 ± 2 mg/kg). Pokud se během vyšetření hladina HCO v séru pacienta výrazně sníží, je lepší použít nikoli diakarb, ale hydrogenuhličitan sodný. pCO2 v moči se stanoví až poté, co pH moči překročí 7,4 a/nebo je koncentrace HCO3 vyšší než 40 mEq/l.
Tin IV PTA (distální varianta PTA) spojená s nízkým pH moči (< 6,0) и гиперкалиемией, при котором в дистальных канальцах нарушена секреция как Н+, так и К-, связан с неспособностью почек реабсорбировать натрий, что благоприятствует развитию отрицательного потенциала в просвете канальцев или «вольтаж-зависимого» дефекта.
Tato forma všech variant PTA je nejčastější jak u dospělých, tak u dětí. Dochází také k porušení renální syntézy amonia. Vzhledem k tomu, že amoniogeneze je při hyperkalemii inhibována, vede to ke snížení obsahu amonia, který slouží jako pufr v moči, a tedy ke snížení pH moči namísto snížení sekrece H- (NH3 + H+ = NH4) .
PTA typu IV je fyziologicky ekvivalentní deficitu aldosteronu, který může být jednou z příčin této patologie. U dětí je tento typ PTA projevem skutečného hypoaldosteronismu, ale mnohem častější je při parenchymálním poškození ledvin, zejména při obstrukční uropatii. Po odstranění obstrukčních poruch se projevy PTA IV. typu během několika týdnů či měsíců snižují.
K.U. Ashcraft, T.M. Držák
Odeslat svou dobrou práci do znalostní báze je jednoduché. Použijte níže uvedený formulář
Studenti, postgraduální studenti, mladí vědci, kteří využívají znalostní základnu ve svém studiu a práci, vám budou velmi vděční.
Hostováno na http://allbest.ru/
Ministerstvo zdravotnictví Běloruské republiky
EE "Grodno State Medical University"
na téma "Funkční testy při hodnocení koncentrační funkce ledvin."
Grodno 2012
Úvod
Ledviny jsou hlavním orgánem pro udržení homeostázy v těle, kterou zajišťují následující funkce:
Zajištění stálosti acidobazického, elektrolytového složení krve;
Udržování objemu krve a dalších tekutin vnitřního prostředí;
Vylučování konečných produktů metabolismu a cizorodých látek;
Sekrece fyziologicky aktivních látek (renin, prostaglandiny, erytropoetin, aktivní formy vitaminu D).
Realizace každé z funkcí je zajištěna několika procesy, které jsou základem činnosti ledvin: glomerulární filtrace, tubulární reabsorpce a sekrece, syntéza nových látek ve strukturách ledviny.
Osmotická koncentrace a osmotické ředění moči hrají důležitou roli v mechanismu tvorby moči a udržování osmotické homeostázy v těle.
Osmotická koncentrace – tvorba moči s vyšší koncentrací osmoticky aktivních látek než v krevní plazmě. Osmotické ředění moči - vylučování moči s nižší koncentrací osmoticky aktivních látek než v krevní plazmě.
Indikátory osmotické koncentrace jsou osmolarita a osmolalita. Osmolarita (mOsm / l) - koncentrace osmoticky aktivních látek v 1 litru roztoku. Osmolalita (mOsm / kg H2O) - koncentrace osmoticky aktivních látek v 1 kg vody (t.j. rozpouštědla).
Faktory, které určují osmolalitu plazmy, jsou koncentrace sodíku, glukózy, dusíkatých produktů (hlavně močoviny), dále normálně nepřítomné (tzv. neměřené) osmoly - alkoholy, mannitol. Osmolalita plazmy je jedním z nejpřísněji dodržovaných fyzikálně-chemických parametrů s variačním koeficientem 1,67 % (pro srovnání: variační koeficient pro draslík je 6,6 %) [Yu. V. Natochin, 1993]. Normální osmolalita plazmy je 280-295 mOsm/kg H2O.
Osmolalita moči je určena především elektrolyty a močovinou a činí 300-800 mOsm/kg H2O. Ale v závislosti na hodnotách příjmu tekutin a extrarenálních ztrát se může pohybovat v širším rozmezí - od 200 do 1200 mOsm / kg H2O.
Procesu osmotické koncentrace moči v ledvině se účastní všechna oddělení tubulů, intersticiální tkáně a cév dřeně.
Mechanismy osmotické koncentrace moči:
* Proximální tubul: reabsorpce vody a osmoticky aktivních látek (hlavně sodíku a močoviny) probíhá v takovém poměru, že osmolalita tubulární tekutiny zůstává stejná jako osmolalita plazmatického ultrafiltrátu (280-295 mOsm/kg H2O).
* Sestupný úsek Henleho smyčky (stěna je propustná pro vodu, nepropustná pro osmoticky aktivní látky): reabsorpce vody pokračuje do intersticia po osmotickém gradientu. Jak se pohybujete od kortikální vrstvy podél dřeně ledviny k vrcholům pyramid, množství tubulární tekutiny se postupně snižuje a její osmolalita se zvyšuje a dosahuje 1200-1500 mOsm / kg H2O v bodě otáčení sestupné části smyčku Henle do vzestupné části.
* Tenký vzestupný úsek Henleovy smyčky (propustný pro vodu): v tomto úseku je koncentrace osmoticky aktivních látek v tubulární tekutině vyšší než v intersticiu, takže voda vstupuje do lumen tohoto úseku podél osmotického gradientu od intersticiální tkáň.
* Silná vzestupná část Henleho smyčky (stěna je nepropustná pro vodu, ale propustná pro sodík, chlór): když tekutina prochází touto částí, dochází k aktivní reabsorpci sodíku a chlóru a voda zůstává v lumen tubulů a hypotonický vždy vstupuje do počátečních úseků kapaliny distálního stočeného tubulu (méně než 200 mOsm/kg H2O).
* Distální tubuly, sběrné kanálky: probíhající proces reabsorpce vody, osmoticky aktivních látek (sodík, močovina) je regulován antidiuretickým hormonem (ADH).
ADH zvyšuje propustnost stěn distálních tubulů a sběrných kanálků pro vodu, zvyšuje reabsorpci sodíku a chlóru v buňkách vzestupné tlusté Henleovy smyčky a zvyšuje propustnost stěn sběrných kanálků pro močovinu v medulla ledviny. Působením ADH se tedy zvyšuje reabsorpce vody z lumen tubulů do intersticiální tkáně ledvin. Výsledkem je, že se vylučuje málo moči s vysokým obsahem osmoticky aktivních látek v ní (až 1200 mOsm / kg H2O). Při deficitu ADH se snižuje propustnost stěn distálního segmentu nefronu a sběrných kanálků pro vodu, sodík se nadále reabsorbuje do intersticiální tkáně a snižuje se akumulace močoviny v dřeni ledvin. To vede ke snížení reabsorpce vody, uvolnění velkého množství hypoosmolární moči (asi 400 mOsm / kg H2O).
Udržování vodní rovnováhy v těle zajišťuje regulační systém zahrnující volumoreceptory, osmoreceptory, natrioreceptory, nervová a humorální centra. Při dehydrataci organismu se zvyšuje koncentrace osmoticky aktivních látek v krevní plazmě, excitují se osmoreceptory, zvyšuje se sekrece ADH a zvyšuje se absorpce vody v tubulech. Aktivace volomoreceptorů (se zvýšením vody a sodných solí v těle) vede ke snížení sekrece ADH, aktivaci natriuretického hormonu, snížení sekrece reninu, angiotensinu a aldosteronu. To vede ke snížení reabsorpce sodíku, zvýšení diurézy. Nakonec se objem krve a extracelulární tekutiny obnoví.
Hodnocení koncentrační funkce
homeostáza ledvin osmotická moč
K posouzení koncentrační funkce ledvin se používá řada metod:
1. Stanovení relativní hustoty a osmolality moči.
Relativní hustota je dána množstvím rozpuštěných látek v moči. Relativní hustota moči je ovlivněna povahou potravy, množstvím vypité tekutiny, závažností extrarenálních ztrát, povahou částic rozpuštěných v moči (bílkoviny, cukry). Normálně, za normálních podmínek, je relativní hustota 1008-1025 g/l.
Osmolalita moči je přísnější ukazatel, méně závislý na povaze rozpuštěných částic. Osmolalita a relativní hustota spolu úzce souvisí (tabulka 1). Použití jednotek osmolality umožňuje srovnání moči a krve.
2. Zimnitského test je jednou z nejjednodušších a nejdostupnějších metod pro studium funkce ledvin. Pomocí Zimnitského testu lékař určuje takové funkce ledvin, jako je schopnost koncentrace a vylučování moči. Zimnitsky test také dává představu o práci srdce.
Co určuje Zimnitského test?
Analýza moči podle Zimnitského umožňuje lékaři určit schopnost ledvin koncentrovat moč. Koncentrační schopnost ledvin je přirozený regulační mechanismus, který umožňuje tělu udržovat konstantní tekuté prostředí. Takže například se zvýšením množství tekutin v těle (hojné pití, tekutá strava) ledviny vylučují velké množství zředěná moč moč. Naopak, pokud lidské tělo přijímá málo vody, začnou ledviny produkovat velmi koncentrovanou moč a šetřit tak tekutiny.
Analýza moči podle Zimnitského zjišťuje hustotu moči – jedná se o ukazatel, který vyjadřuje množství metabolických produktů rozpuštěných v moči (soli, bílkoviny, čpavek atd.). Hustota moči závisí na množství spotřebované tekutiny a také na koncentrační schopnosti ledvin. Normální hustota moči se pohybuje od 1,003 do 1,035. Během dne člověk spotřebuje nestejné množství tekutin, takže hustota moči v jiný čas změny dne: během dne je moč méně hustá díky příjmu tekutin, ranní moč má naopak nejvyšší hustotu.
Pomocí Zimnitského testu se zjišťuje i denní diuréza – celkové množství moči vyloučené během dne. Běžně se během dne vyloučí asi 1,5-2 litry moči. Pomocí Zimnitského testu se zjišťuje, kolik moči bylo uvolněno ve dne a kolik v noci. Denní výkyvy diurézy (různé množství moči uvolněné během dne a v noci) odhalují některé abnormality v práci ledvin nebo srdce.
Jak se odebírá moč pro Zimnitského test?
Sběr moči pro Zimnitského test se provádí do jednoho dne. Během sběru moči by měl subjekt jíst jako obvykle a přijímat pro sebe obvyklé množství tekutin (nejlépe ne více než 1,5–2 litry tekutin denně). Souběžně se sběrem moči je nutné vypočítat množství odebraných tekutin (včetně tekuté stravy), protože to je důležité pro výpočet výsledků rozboru.
Subjekt dostane 8 sklenic, do každé z nich by se měla po dni shromáždit moč. První den v 6 hodin ráno subjekt vyprázdní močový měchýř do záchodu. Poté, přesně každé 3 hodiny, byste měli veškerou moč shromáždit do příslušné nádoby. Moč se tedy odebírá v 9, 12, 15, 18, 21, 24, 3 a 6 hodin ráno následujícího dne. Celkem se získá 8 porcí moči, jedna porce moči v každé sklenici.
Všechny sklenice s močí, stejně jako údaje o tom, kolik tekutiny bylo vypito během dne, jsou odeslány do laboratoře. Před odesláním vzorků moči do laboratoře se doporučuje uchovávat je v chladničce.
Jaké jsou normy Zimnitského testu?
Pomocí Zimnitského testu se posuzuje několik parametrů funkce ledvin: hustota moči, kolísání hustoty moči během dne, množství tekutiny vyloučené během dne, kolísání množství tekutiny vylučované ve dne a v noci. Při normální funkci ledvin jsou výsledky Zimnitského testu následující:
Množství moči vyloučené během dne (denní diuréza) - 1500 - 2000 ml
Poměr množství tekutin vyloučených ledvinami k množství tekutin vypitých během dne je 65 - 80 %.
Množství moči vyloučené během dne výrazně převyšuje množství moči vyloučené v noci (2/3 celkové moči během dne, 1/3 v noci)
Hustota moči v jedné nebo více porcích není menší než 1,020
Výrazné kolísání množství a hustoty moči v různých porcích během dne. Například přes den je jedna porce 300 ml a v noci 50 ml. Nebo v jedné části moči je hustota 1,008 a ve druhé části - 1,022.
Interpretace (dekódování) výsledků Zimnitského testu.
Při provádění Zimnitského testu u lidí s poruchou funkce ledvin jsou pozorovány různé odchylky od normy. Hlavní porušení zjištěná pomocí Zimnitského testu jsou následující:
Nízká hustota moči je výsledkem Zimnitského testu, ve kterém v žádné z porcí nepřesahuje hustota moči 1,012-1,013. Nízká hustota moči se nazývá hypostenurie a ukazuje na porušení koncentrační schopnosti ledvin.
K porušení koncentrace moči dochází při užívání diuretických léků (furosemid, kyselina etakrynová atd.), Stejně jako u následujících onemocnění:
Pozdní stadia chronického selhání ledvin se vyskytují u lidí, kteří dlouhodobě trpí některými onemocněními ledvin (glomerulonefritida, pyelonefritida, amyloidóza ledvin atd.) U chronického selhání ledvin jsou pozorovány tyto hlavní příznaky: zhoršení obecně stav, bolesti hlavy, letargie, ztráta chuti k jídlu, žízeň, zápach z úst. Při biochemické analýze krve zvýšení hladiny kreatininu, močoviny atd.
Exacerbace oboustranné pyelonefritidy neboli zánět pánve obou ledvin je také příčinou poklesu hustoty moči. U pyelonefritidy jsou hlavními příznaky: periodické bolesti v bederní oblasti, horečka až vysoká čísla, bolesti hlavy, nevolnost atd.
Závažné srdeční selhání vede v některých případech k poškození ledvin a zhoršené koncentraci moči. Při špatné činnosti srdce dochází ke stagnaci krve v ledvinách a dalších orgánech, což vede k narušení jejich práce. Při srdečním selhání je výrazná dušnost, slabost, bolesti hlavy, otoky nohou, je možná vodnatelnost (ascites).
Diabetes insipidus je onemocnění, při kterém v důsledku nedostatku specifického hormonu (vazopresinu) nejsou ledviny schopny vracet tekutinu z moči. Tělo ztrácí hodně tekutin močí. Příznaky diabetes insipidus jsou: silná žízeň, časté močení, hubnutí, suchá kůže, velké množství moči za den (až 5-10 litrů) atd.
Nízká hustota moči, která se prakticky nemění v závislosti na denní době nebo množství přijatých tekutin, se nazývá hypoisostenurie. Při hypoisostenurii hustota moči v každé části Zimnitského testu zpravidla nepřesahuje 1,009 a prakticky se během dne nemění. Takový výsledek Zimnitského testu naznačuje, že ledviny nejsou schopny přizpůsobit se měnícím se podmínkám pro příjem tekutiny do těla a naznačuje vážné selhání ledvin.
Zvýšení hustoty moči zpravidla naznačuje pronikání velkého množství husté látky (například bílkovin, glukózy atd.) do moči. Nemoci, u kterých je zvýšená hustota moči, jsou následující :
Diabetes způsobuje velké množství glukózy, které se vylučuje močí. Přítomnost glukózy v moči zvyšuje její hustotu. Zpravidla při přítomnosti glukózy v moči (glukosurie) dochází k častému močení, žízni, hubnutí, zvýšené chuti k jídlu a dalším příznakům cukrovky.
Akutní nebo chronická glomerulonefritida je onemocnění, při kterém je narušena propustnost glomerulů ledvin a do moči se dostávají velké krevní látky: krvinky, bílkoviny. Přítomnost bílkoviny v moči se nazývá proteinurie. Protein je důvodem zvýšení hustoty moči. Kromě toho lze u glomerulonefritidy pozorovat hematurii (přítomnost krve v moči, viz Analýza moči podle Nechiporenka), bolesti v bederní oblasti, horečku atd.
Toxikóza těhotných žen v některých případech přispívá ke zvýšení hustoty moči v důsledku vylučování bílkovin močí.
Jak bylo uvedeno výše, běžně člověk vyloučí 65 až 80 % tekutin zkonzumovaných během dne. Pokud během dne subjekt se srdečním selháním a edémem vyloučil méně než 65 % přijatých tekutin, znamená to, že se onemocnění zhoršuje a edém narůstá. Pokud je vylučování moči více než 80 % z množství přijatých tekutin, stav se zlepšuje, otoky ustupují.
Zvýšení množství moči vyloučené během dne o více než 2000 ml se nazývá polyurie a je pozorováno za následujících podmínek:
Diabetes způsobuje vylučování glukózy močí, která stahuje tekutinu do moči. Při cukrovce se zvyšuje množství vyloučené moči během dne.
Diabetes insipidus je nedostatek hormonu, který podporuje zadržování vody v těle (vazopresin). Absence tohoto hormonu je příčinou velkých ztrát vody močí.
Selhání ledvin se vyskytuje u lidí s onemocněním ledvin. Při selhání ledvin nejsou ledviny schopny koncentrovat moč, což má za následek zvýšené vylučování tekutin močí.
Reizelmanův test je modifikací Zimnitského testu, podle kterého se sběr moči provádí ve volných časových intervalech. Používá se v dětství.
Při zachované schopnosti ledvin osmotického ředění a koncentrace moči jsou zaznamenány následující:
Výrazné kolísání objemu moči v jednotlivých porcích (50-250 ml);
Maximální relativní hustota charakterizující schopnost ledvin koncentrovat moč by neměla být nižší než 1025 g/l;
Minimální relativní hustota, která odráží schopnost ledvin osmoticky ředit moč, by u zdravého člověka měla být nižší než osmotická koncentrace (osmolalita) bezproteinové plazmy, rovna 1010-1012, a obvykle je 1003-1006;
Významné kolísání relativní hustoty moči: rozdíl mezi maximální a minimální hodnotou by měl být alespoň 12-16 jednotek. (například od 1006 do 1020 nebo od 1010 do 1026 atd.); výrazné denní výkyvy relativní hustoty moči jsou spojeny se zachovanou schopností ledvin buď koncentrovat nebo ředit moč, v závislosti na neustále se měnících potřebách organismu;
Zřetelná (přibližně dvojnásobná) převaha denní diurézy nad noční.
3. Zatěžovací zkoušky. Zkouška koncentrace.
Subjekt je v suché stravě po dobu 12-24 hodin. Voda, ovoce, bobule, zelenina jsou vyloučeny ze stravy, jsou zahrnuty drobivé cereálie, sušenky, vejce natvrdo, tvaroh a maso. Studie začíná v 15.00, močový měchýř se vyprázdní, poté se každé 3 hodiny odebírá moč, zjišťuje se množství moči, relativní hustota nebo osmolalita. Konečný čas vzorku se určuje podle získaných výsledků (dosažením úrovně specifické hmotnosti 1025 g/l a vyšší) a také s ohledem na pohodu pacienta.
*děti nízký věk
* onemocnění centrálního nervového systému
* aktivita zánětlivého procesu v ledvinách
* selhání ledvin
* metabolická nefropatie (včetně neuroartritické diatézy).
Základem porušení koncentrační schopnosti ledvin je snížení osmotického tlaku v tkáni dřeně ledvin. To může být způsobeno jak poškozením samotných ledvin, tak extrarenálními faktory (tab. 2).
S progresí onemocnění ledvin je snížení koncentrační schopnosti kombinováno s porušením schopnosti ledvin ředit.
4. Zatěžovací zkoušky. Test vodní zátěže.
Během studie se nepodává jídlo, pacient je na pololůžku. použití vařící voda pokojové teploty 20 ml/kg, který se vypije do 15-30 minut. Poté se močový měchýř vyprázdní a každých 30 minut se shromažďuje moč po dobu dvou hodin (4 porce) a další 1–2 hodiny po hodině (1–2 porce). Aby se dosáhlo trvalé maximální diurézy, na začátku každého pravidelného odběru moči je dítěti dáno vypít množství vody, které se rovná objemu moči získané za předchozí období, plus množství vody pro extrarenální ztráty.
Kontraindikace testu:
* edematózní syndrom
* hypertenzní syndrom
* srdeční selhání
* stavy doprovázené tachykardií.
Interpretace výsledků:
V prvních dvou hodinách zdravé dítě vyloučí minimálně 70 % vypitého tekutého nápoje, přičemž relativní hustota moči klesá (až na 1001-1005 g/l);
Při snížení schopnosti ledvin ředit moč hodnoty relativní hustoty nedosahují těchto ukazatelů (obvykle 1004-1009 g / l);
Při úplné ztrátě diluční funkce je relativní hustota na úrovni 1010-1012 g/l, to znamená, že odpovídá osmotické koncentraci plazmy (izostenurie).
Oligurie v důsledku poruchy funkce ledvin je ve většině případů kombinována se snížením osmolality moči (nebo specifické hmotnosti). Oligurie u pacientů se zachovanou funkcí ledvin je doprovázena močí s normální nebo zvýšenou specifickou hmotností.
Zátěžové testy umožňují posoudit funkční stav ledvin a jejich rezervní schopnosti, ale přítomnost řady kontraindikací (včetně raného dětství) omezuje jejich použití.
V současnosti se k hodnocení koncentrační funkce ledvin používá desmopresin (syntetický analog přirozeného antidiuretického hormonu arginin-vasopresin). Ve srovnání s přirozeným hormonem má desmopresin silnější a prodloužený účinek a nemá výrazný vazokonstrikční účinek.
Jednou z lékových forem desmopresinu je Precynex, dávkovaný nosní sprej. Podle výsledků zahraničních multicentrických studií se lék vyznačuje vysokou přesností dávkování, pohodlnou formou uvolňování, bezpečnou a efektivní způsob aplikace, nezpůsobuje atrofii nosní sliznice.
Dávky Precynexu pro test renální koncentrace závisí na věku:
Průměrná dávka
Dospělí - 40 mcg / den
Děti do jednoho roku - 10 mcg / den
Děti starší než rok - 10-20 mcg / den
Provedení testu koncentrační schopnosti ledvin pomocí Precynexu zajišťuje důsledné splnění následujících podmínek:
* Vyprázdněte močový měchýř (první část se nalije). Opakovaný odběr moči se provádí 4 hodiny po prvním vyprázdnění močového měchýře.
* Další odběr moči - po 4 hodinách.
*K určení osmolality se během 8 hodin odeberou pouze dvě porce moči.
* Během studie omezte množství odebraných tekutin (objem tekutin přijatých 1 hodinu před studií a do 8 hodin po ní by neměl překročit 0,5 litru).
Získané výsledky jsou hodnoceny z hlediska osmolality.
* Norma osmolality pro dospělé je až 1200 mOsm / kg H2O.
* U dětí je míra osmolality 600 mOsm / kg H2O (mělo by být dosaženo do 5 hodin po podání léku).
* Pokud je zjištěná osmolalita pod uvedenými hodnotami, je nutné test opakovat. Opětovná identifikace nízkého indikátoru naznačuje porušení koncentrační schopnosti ledvin. V tomto případě pacient potřebuje další hloubkové vyšetření.
Použití Precynexu je tedy novou neinvazivní metodou pro diagnostiku poruch koncentrační funkce ledvin, a to i u malých dětí.
Literatura
1. Materiály ruské vědecko-praktické konference "Aktuální problémy dětské nefrologie". - Orenburg, 21. - 23. května 2010 - Orenburg, 2010.
2. Natochin Yu. V. Úvod do nefrologie / Yu. V. Natochin, N. A. Mukhin. - OOO Argument, GEOTAR-MEDIA, PUBLISHING GROUP, 2007 - 160 s.
3. Nefrologie v terapeutické praxi / Ed. A. S. Chizha. - Minsk: Vyšší škola, 1998. - 557 s.
4. Papayan A. V. Klinická nefrologická příručka pro lékaře / A. V. Papayan, N. D. Savenkova. - Petrohrad: SOTIS, 1997. - 720 s.
5. Průvodce somatických nemocí
Hostováno na Allbest.ru
Podobné dokumenty
Morfofunkční charakteristiky močového systému. Anatomie ledvin. Struktura ledvin. Mechanismus močení. Krevní zásobení ledvin. Porušení funkcí močového systému v patologii, pyelonefritida. Metody vyšetření moči a funkce ledvin.
abstrakt, přidáno 31.10.2008
Etiologie a patogeneze poruchy funkce ledvin: glomerulární a tubulární filtrace, reabsorpce, sekrece, koncentrace a ředění moči. Klinická diagnostika onemocnění ledvin, laboratorní výzkum a rozbor fyzikálních a chemické vlastnosti moč.
semestrální práce, přidáno 15.06.2015
Vlastnosti patologie ledvin. Časté příčiny dysfunkce ledvin. Projevy poruch močení a pomočování. Projevy poruch ledvin. Mechanismy poruchy vylučovací funkce ledvin. Hlavní typy patologie ledvin podle původu.
prezentace, přidáno 03.05.2017
Mechanismy tvorby moči. Renální a extrarenální cesty vylučování látek. Základní funkce ledvin. Průtok krve v různých částech ledvin. Struktura oběhového systému. Klasifikace nefronů. Mechanismy močení. Filtrace, reabsorpce, sekrece.
prezentace, přidáno 01.12.2014
Studium stížností nefrologických pacientů, sběr anamnézy u pacienta s podezřením na onemocnění ledvin. Přehled příčin exacerbace, povaha průběhu onemocnění, palpace. Analýza kvantitativní metody studium močového sedimentu, syndrom selhání ledvin.
prezentace, přidáno 25.12.2011
Struktura orgánů lidského močového systému: močový měchýř, močovody, pánev, ledvinové kalichy, močová trubice. Fáze metabolismu v těle. Zohlednění funkcí ledvin: vylučovací, ochranná a udržující homeostázu.
prezentace, přidáno 15.04.2013
Úvaha o syndromu zhoršené funkce ledvin, vedoucí k poruše vodního, elektrolytového, dusíkového a dalších typů metabolismu. Kritéria RIFLE pro diagnostiku a klasifikaci akutního poškození ledvin. Standardizace definic poruchy funkce ledvin.
prezentace, přidáno 30.05.2014
Interoceptivní funkce ledvin. Studium vlivu jedné ledviny na druhou. Role renální recepce při vzniku hypertenze. Denervovaná ledvina. Úloha bloudivých nervů při provádění reflexních reakcí zaměřených na udržení iontové rovnováhy.
abstrakt, přidáno 06.01.2010
Topografie ledvin, jejich skeletotopie. Vlastnosti topografické anatomie ledvin, ledvinových cév, močovodů a močového měchýře v dětství. Solitární cysty ledvin. Důsledky a příčiny rozvoje hypoplazie. Patologie duplikace ledvin, její typy.
prezentace, přidáno 09.07.2015
Základní funkce ledvin. Pravidla pro sběr moči pro výzkum. Barva, vůně, kyselost moči, obsah glukózy, erytrocytů, leukocytů a bílkovin v ní. Funkční a patologická proteinurie. Projevy nefrotického a azotemichetického syndromu.
Porušení koncentrační schopnosti ledvin za různých podmínek (žízeň, vodní zátěž) a se změnami osmolarity plazmy se projevuje hypostenurií, izostenurií a astenurií.
Hypostenurie - omezení koncentrační schopnosti ledvin při různé osmolaritě moči (od maxima k minimu). V tomto případě může specifická hmotnost moči dosáhnout 1,025 a osmolarita moči - 850 mmol / l. Isosthenurie- stav charakterizovaný výrazným omezením koncentrační funkce ledvin, přičemž specifická hmotnost moči nepřesahuje 1,010 a osmolarita moči je 300 mmol / l. Astenurie nazývaný stav, kdy je koncentrační schopnost ledvin skutečně zcela narušena. Specifická hmotnost moči nepřesahuje 1,001, osmolarita moči je pod 50 mmol/l.
Základem porušení koncentrační schopnosti ledvin mohou být metabolické, endokrinní, hemodynamické, morfologické změny v ledvinách. Snížení osmotického gradientu mezi tubulární močí a medullou je zásadní. Takže při osmotické diuréze v tubulární moči se zadrží nadbytečné množství osmoticky aktivních, nereabsorbovatelných látek (například manitol, močovina, glukóza - nad renálním prahem), které brání toku tekutiny z lumen tubul do intersticia.
Koncentrační schopnost ledvin je u podvyživených pacientů snížena, protože v důsledku jejich nedostatku energie a transportních ATPáz se zpomaluje pohyb látek proti koncentračnímu gradientu z tubulární moči, která má nízkou osmolaritu, do dřeně.
Reabsorpce sodíku v distálních tubulech je narušena během hypoxie, hypotermie a diuretik, což brání rozvoji hyperosmolarity v renálním parenchymu. Naopak aldosteron přispívá k rozvoji hyperosmolarity v ledvinové tkáni.
Porušení renální hemodynamiky se zvýšením systémového arteriálního tlaku, omezení průtoku krve ledvinami, zánětlivá hyperémie u tubulointersticiální nefritidy může způsobit snížení osmotického gradientu a tím přispět ke snížení koncentrační funkce ledvin.
Poškození tubulárních buněk je doprovázeno změnami ve složení a objemu moči. Dysfunkce proximálních tubulů se projevuje snížením sekrece [H + ] iontů a zpětným vstřebáváním bikarbonátů a vody, druhé v důsledku blokády protiproudého mechanismu a vylučování velkého objemu zředěné moči. V tomto případě se zpravidla ztrácí schopnost buněk distálních tubulů a sběrných kanálků reagovat na ADH. Závažné poruchy koncentrační funkce ledvin jsou pozorovány s nedostatkem ADH nebo nedostatečnou citlivostí na tento hormon tubulárních buněk. Tato nemoc se nazývá diabetes insipidus, která je centrálního a renálního původu. Pro účely diferenciální diagnostiky těchto dvou stavů se provádí test solné zátěže k identifikaci zbývající citlivosti renálních tubulárních buněk k ADH a schopnosti koncentrovat moč.
Při poškození nefrocytů se snižuje citlivost buněk na aldosteron a blokují se metabolické mechanismy zahrnující sodík. V moči se koncentrace sodíku zvyšuje neúměrně ve srovnání s krevní plazmou.
Poškození proximálních tubulů je doprovázeno snížením reabsorpce draslíku a v důsledku toho hypokalémií. Porušení reabsorpce glukózy, fosfátů, aminokyselin, urátů vede ke snížení jejich hladiny v krvi a tkáních, a tedy ke změně metabolismu.
Pokud jsou tedy v žilní krvi proudící z ledvin poškozeny tubuly, stanoví se kyselé pH, hypokarbonátémie, hypokalémie, hypofosfatemie, hypourikemie a normální hladiny močoviny a kreatininu. Objem moči je zvýšený, je dán poměrně vysokou koncentrací sodíku i při poklesu prokrvení ledvin a neúměrně nízké koncentraci močoviny.